
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反應物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

| 1.2g |
| 12g/mol |
| 1.68L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.2g |
| 12g/mol |
| 1.68L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源: 題型:閱讀理解
 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:
 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省宿遷市高三上學期第一次摸底考試化學試卷(解析版) 題型:填空題
研究CO2的利用對促進低碳社會的構建具有重要意義。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H 1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H 2=+172.5 kJ·mol-1
則CO還原Fe2O3(s)的熱化學方程式為 。
(2)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H
CH3OH(g)+H2O(g)
△H
①該反應的平衡常數表達式為K= 。
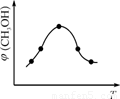
②取一定體積CO2和H2的混合氣體(物質的量之比為1∶3),加入恒容密閉容器中,發生上述反應。反應過程中測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系如圖所示,則該反應的ΔH 0(填“>”、“<”或“=”)。
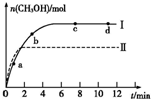
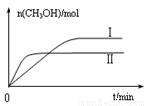
③在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖所示,曲線I、Ⅱ對應的平衡常數大小關系為KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2為原料還可以合成多種物質。
①工業上尿素[CO(NH2)2]由CO2和NH3在一定條件下合成,其反應方程式為 。當氨碳比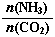 =3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為
=3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為
。
②用硫酸溶液作電解質進行電解,CO2在電極上可轉化為甲烷,該電極反應的方程式為 。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省蘇南四校高三12月月考試化學試卷(解析版) 題型:填空題
(14分)研究CO2的利用對促進低碳社會的構建具有重要的意義。
(1)已知石墨的標準燃燒熱為y kJ·mol-1,1.2g石墨在1.68L(標準狀況)氧氣中燃燒,至反應物耗盡,放出x kJ熱量。則石墨與氧氣反應生成CO的熱化學方程式為 ,
(2)高溫時,用CO還原MgSO4可制備高純MgO。
①750℃時,測得氣體中含等物質的量SO2和SO3,此時反應的化學方程式是 。
②由MgO可制成“鎂—次氯酸鹽”燃料電池,其裝置示意圖如圖1,該電池反應的離子方程式為 。



圖1 圖2 圖3
(3)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①該反應的平衡常數表達式為K= 。
②取五份等體積CO2和H2的混合氣體(物質的量之比均為1∶3),分別加入溫度不同、容積相同的恒容密閉容器中,發生上述反應,反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系曲線如圖2所示,則上述CO2轉化為甲醇反應的ΔH (填“>” “<”或“=”)0。
③在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖3所示,曲線I、Ⅱ對應的平衡常數大小關系為KⅠ KⅡ(填“>” “<”或“=”)。
④一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式投入反應物,一段時間后達到平衡。
|
容 器 |
甲 |
乙 |
|
反應物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后氣體的壓強為開始時的0.8倍,要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持反應逆向進行,則c的取值范圍為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com