
【題目】某有機物的結構簡式為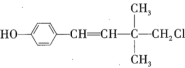 ,下列關于該有機物的說法錯誤的是( )
,下列關于該有機物的說法錯誤的是( )
A.有順反異構B.可以和濃溴水發生取代反應和加成反應
C.可以發生加聚反應、水解反應和消去反應D.1mol該有機物最多能與![]() 發生加成反應
發生加成反應
【答案】C
【解析】
A.由該有機物的結構簡式可知,該有機物分子中含有一個碳碳雙鍵,且碳碳雙鍵的兩個碳原子上均連有不同的基團,所以該有機物有順反異構,故A正確;
B.該有機物分子中含有酚羥基和碳碳雙鍵,酚羥基所連碳原子的鄰位碳原子上的氫原子可被溴原子取代,碳碳雙鍵可與溴水發生加成反應,故B正確;
C.該分子中含有碳碳雙鍵,可發生加聚反應,含有氯原子,可發生水解反應,但與氯原子相連的碳原子的相鄰碳原子上沒有氫原子,所以不能發生消去反應,故C錯誤;
D.該有機物分子含有1苯環和1個碳碳雙鍵,1mol碳碳雙鍵可與1mol氫氣分子發生加成反應,1mol苯環可與3mol氫氣分子發生加成反應,所以1mol該有機物最多能與4molH2發生加成反應,故D正確;
綜上所述,答案為C。


科目:高中化學 來源: 題型:
【題目】如下圖所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列說法或表示式正確的是
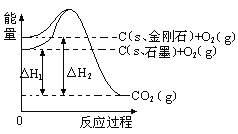
A.石墨和金剛石的轉化是物理變化
B.1mol石墨的總能量比1 mol金剛石的總能量大1.9 kJ
C.金剛石的穩定性強于石墨
D.C(s、石墨)=C(s、金剛石) △H=" +1.9" kJmol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于自然界中氮循環(如圖)的說法不正確的是:

A. 氮元素均被氧化
B. 工業合成氨屬于人工固氮
C. 含氮無機物和含氮有機物可相互轉化
D. 碳、氫、氧三種元素也參與了氮循環
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高聚物![]() (結構簡式如圖所示)是一種來源于生物學靈感的新型粘合劑,其原料取材于植物和貽貝。下列關于高聚物
(結構簡式如圖所示)是一種來源于生物學靈感的新型粘合劑,其原料取材于植物和貽貝。下列關于高聚物![]() 的說法錯誤的是( )
的說法錯誤的是( )
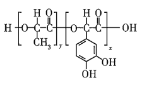
A.高聚物![]() 的單體之一為
的單體之一為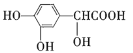
B.高聚物![]() 在一定條件下能發生水解反應
在一定條件下能發生水解反應
C.發生聚合反應時,生成![]() 的同時,會有
的同時,會有![]() 生成
生成
D.![]() 最多可與
最多可與![]() 發生加成反應
發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎頒給了日本吉野彰等三人,以表彰他們對鋰離子電池研發的卓越貢獻。
(1)工業中利用鋰輝石(主要成分為LiAlSi2O6,還含有FeO、CaO、MgO等)制備鈷酸鋰(LiCoO2)的流程如圖:
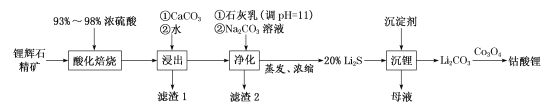
回答下列問題:
①鋰輝石的主要成分為LiAlSi2O6,其氧化物的形式為___。
②為提高“酸化焙燒”效率,常采取的措施是___。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙燒”中過量的硫酸,控制pH使Fe3+、A13+完全沉淀,則pH至少為___。(已知:,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,完全沉淀后離子濃度低于1×l0-5)mol/L)。
④“濾渣2”的主要化學成分為___。
⑤“沉鋰”過程中加入的沉淀劑為飽和的___(化學式)溶液。
(2)利用鋰離子能在石墨烯表面和電極之間快速大量穿梭運動的特性,開發出石墨烯電池,電池反應式為LiCoO2+C6![]() LixC6+Li1-xCoO2其工作原理如圖2。下列關于該電池的說法正確的是___(填字母)。
LixC6+Li1-xCoO2其工作原理如圖2。下列關于該電池的說法正確的是___(填字母)。
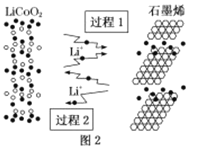
A.過程1為放電過程
B.該電池若用隔膜可選用質子交換膜
C.石墨烯電池的優點是提高電池的儲鋰容量進而提高能量密度
D.充電時,LiCoO2極發生的電極反應為LiCoO2-xe-=xLi++Li1-xCoO2
E.對廢舊的該電池進行“放電處理”讓Li+嵌入石墨烯中而有利于回收
(3)LiFePO4也是一種電動汽車電池的電極材料,實驗室先將綠礬溶解在磷酸中,再加入氫氧化鈉和次氯酸鈉溶液反應獲得FePO4固體。再將FePO4固體與H2C2O4和LiOH反應即可獲得LiFePO4同時獲得兩種氣體。
①寫出FePO4固體與H2C2O4和LiOH反應溶液獲得LiFePO4的化學方程式___。
②LiFePO4需要在高溫下成型才能作為電極,高溫成型時要加入少量活性炭黑,其作用是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值。下列敘述正確的是
A.含28g硅的SiO2晶體中存在的共價鍵總數為2NA
B.標準狀況下,2.24L乙烯中含有的π鍵數目為0.1NA
C.室溫時,pH=2的鹽酸中H+數目為1.0×10-2NA
D.124gP4(正四面體)中P-P鍵數目為4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,甲酸和乙酸的電離常數分別為1.8×10-4和1.8×10-5。將pH和體積均相同的兩種酸溶液分別稀釋,其pH隨加水體積的變化如圖所示。兩種酸用通式HY表示,下列敘述正確的是
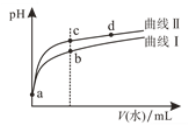
A.曲線Ⅱ代表乙酸
B.酸的電離程度:c點>d點
C.溶液中水的電離程度:b點>c點
D.從c點到d點,溶液中![]() 保持不變
保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃燒0.1 mol某有機物得0.2 mol CO2和0.3 mol H2O,由此得出的結論不正確的是( )
A. 該有機物分子的結構簡式為CH3—CH3
B. 該有機物中碳、氫元素原子數目之比為1∶3
C. 該有機物分子中不可能含有![]() 雙鍵
雙鍵
D. 該有機物分子中可能含有氧原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)是一種解毒藥,用于氟化物、砷、汞、鉛、錫、碘等中毒,臨床常用于治療蕁麻疹,皮膚瘙癢等病癥.硫代硫酸鈉在中性或堿性環境中穩定,在酸性溶液中分解產生S和SO2
實驗I:Na2S2O3的制備。工業上可用反應:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,實驗室模擬該工業過程的裝置如圖所示:

(1)儀器a的名稱是_______,儀器b的名稱是_______。b中利用質量分數為70%80%的H2SO4溶液與Na2SO3固體反應制備SO2反應的化學方程式為_______。c中試劑為_______
(2)實驗中要控制SO2的生成速率,可以采取的措施有_______ (寫出一條)
(3)為了保證硫代硫酸鈉的產量,實驗中通入的SO2不能過量,原因是_______
實驗Ⅱ:探究Na2S2O3與金屬陽離子的氧化還原反應。
資料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
裝置 | 試劑X | 實驗現象 |
| Fe2(SO4)3溶液 | 混合后溶液先變成紫黑色,30s后幾乎變為無色 |
(4)根據上述實驗現象,初步判斷最終Fe3+被S2O32-還原為Fe2+,通過_______(填操作、試劑和現象),進一步證實生成了Fe2+。從化學反應速率和平衡的角度解釋實驗Ⅱ的現象:_______
實驗Ⅲ:標定Na2S2O3溶液的濃度
(5)稱取一定質量的產品配制成硫代硫酸鈉溶液,并用間接碘量法標定該溶液的濃度:用分析天平準確稱取基準物質K2Cr2O7(摩爾質量為294gmol-1)0.5880g。平均分成3份,分別放入3個錐形瓶中,加水配成溶液,并加入過量的KI并酸化,發生下列反應:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入幾滴淀粉溶液,立即用所配Na2S2O3溶液滴定,發生反應I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均體積為25.00 mL,則所標定的硫代硫酸鈉溶液的濃度為_______molL-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com