
【題目】氧化還原反應在生產生活中有很多實際應用:
Ⅰ.二氧化硒(SeO2)是一種氧化劑,其被還原后的單質硒可能成為環境污染物,通過與濃HNO3或濃H2SO4反應生成SeO2以回收Se。
已知:①Se+2H2SO4(濃)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se與濃H2SO4的反應中,氧化劑是_______還原劑是________。
(2)依據反應①判斷SeO2、濃H2SO4的氧化性強弱是:SeO2 ______ 濃H2SO4(填大于、小于或等于).
(3)用雙線橋法標出反應②電子轉移的方向和數目:_________________。
(4)SeO2、KI和HNO3發生如下反應,配平該反應的化學方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.對工業廢水和生活污水進行處理是防止水體污染、改善水質的主要措施。
(5)含氰廢水中的CN-有劇毒。在微生物的作用下,CN-能夠被氧氣氧化成HCO![]() ,同時生成NH3,該反應的離子方程式為_____________________________________________。
,同時生成NH3,該反應的離子方程式為_____________________________________________。
(6)硫酸銅溶液能與單質磷反應:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反應中,被1mol CuSO4 氧化的P的物質的量__________。
【答案】濃硫酸或H2SO4 硒或Se 小于  SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O 2CN-+4H2O+O2
SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O 2CN-+4H2O+O2![]() 2HCO+2NH3 0.2mol
2HCO+2NH3 0.2mol
【解析】
(1)反應Se+2H2SO4(濃)=2SO2↑+SeO2+2H2O中,Se的化合價升高被氧化,做還原劑;濃硫酸中硫元素化合價降低被還原,做氧化劑。
(2)在氧化還原反應中氧化劑的氧化性強于氧化產物的氧化性,因此依據反應①以及(1)中分析可知SeO2、濃H2SO4的氧化性強弱是SeO2小于濃H2SO4。
(3)反應②中,2molSO2共失去4mol電子,失去的電子被SeO2得到,從而被還原為Se,故此反應轉移4mol電子,用雙線橋法標出電子轉移的方向和數目為 。
。
(4)在反應SeO2+KI+HNO3→Se+I2+KNO3+H2O中,SeO2得4個電子,而KI失1個電子,根據得失電子數守恒可知,SeO2的計量數為1,而KI的計量數為4,故Se的計量數為1,I2的計量數為2,根據質量守恒可知,KNO3的計量數為4,則HNO3的計量數為4,水的計量數為2,故方程式為SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O。
(5)含氰廢水中的CN-有劇毒。在微生物的作用下,CN-能夠被氧氣氧化成HCO3-,同時生成NH3,反應中N元素化合價從+2價升高到+4價,失去2個電子,1分子氧氣得到4個電子,根據電子得失守恒、原子守恒以及電荷守恒可知該反應的離子方程式為2CN-+4H2O+O2![]() 2HCO+2NH3。
2HCO+2NH3。
(6)反應11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中銅元素化合價從+2價降低到+1價,得到1個電子,P元素化合價從0價升高到+5價,失去5個電子,則根據電子得失守恒可知被1molCuSO4氧化的P的物質的量是1mol÷5=0.2mol。


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】(1)1mol H2SO4中含___________ 個硫原子,___________mol氧原子。
(2)標準狀況下,①1.7g氨氣、②3.36 L甲烷、③6.02×1022個二氧化碳分子,含原子數最多的是(填序號,下同)________,質量最大的是_________。
(3)9g某二價金屬的氯化物ACl2中含有0.2mol Cl-離子,則ACl2的摩爾質量___________;
(4)某雙原子分子構成的氣體,其摩爾質量為M g/mol,該氣體質量為m g,阿伏加德羅常數為NA,則:
①該氣體在標準狀況下的體積為__________L;
②該氣體的一個分子的質量為__________ g;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于100mL1mol/L鹽酸與鐵片的反應,采取下列措施,其中不能使反應速率加快的是( )
A.升高溫度
B.改用50mL2mol/L鹽酸
C.改用200mL1mol/L鹽酸
D.用等量鐵粉代替鐵片
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由兩種有機物組成的混合物,在一定的溫度和壓強下完全氣化為氣體.在相同的溫度和壓強下,只要混合氣體體積一定,那么無論兩物質以何種比例混合,其完全燃燒時所消耗的氧氣體積就是一定的,符合這種情況的可能組合是:
A. 乙醇(![]() )和乙酸(
)和乙酸(![]() ) B. 乙醛(
) B. 乙醛(![]() )和甲醇(
)和甲醇(![]() )
)
C. 丙醛(![]() )和甘油(
)和甘油(![]() ) D. 丙酮(
) D. 丙酮(![]() )和丙二醇(
)和丙二醇(![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質的組成與結構決定了物質的性質與變化,回答下列問題:
(1)量子力學把電子在原子核外的一個空間運動狀態稱為一個____________,電子除空間運動狀態外,還有一種運動狀態叫做____________。
(2)硒常用作光敏材料,基態硒原子的價電子排布式為_______________;與硒同周期的p區元素中第一電離能大于硒的元素有_________種。
(3)成語“信口雌黃”中的雌黃分子式為As2S3,分子結構如下圖,As原子的雜化方式為___________,雌黃和SnCl2在鹽酸中反應轉化為雄黃(As4S4)和SnCl4并放出H2S氣體,寫出該反應方程式__________________________________________。SnCl4分子的空間構型為_________________
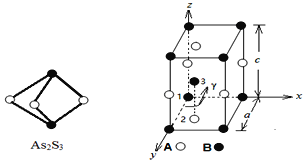
(4)某晶體的晶胞結構如上圖所示,該晶體的化學式為___________,該晶胞參數為:a = 250.4 pm, c = 666.1 pm,γ = 120o;1號原子坐標為(0,0,0),2號原子坐標為(1/3,2/3,0),則3號原子坐標為_____________,計算上述晶體中A和B兩原子間的最小核間距為_____________。(保留四位有效數字)
(5)體心立方堆積的晶胞是個立方體,如果半徑為r的原子保持緊密接觸,立方體的中心能容得下半徑最大為___________的一個原子。
查看答案和解析>>
科目:高中化學 來源: 題型:
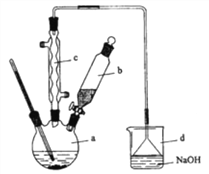
【題目】溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸點/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步驟回答問題:
(1)在a中加入15mL無水苯和少量鐵屑。在b中小心加入4.0mL液態溴。向a中滴入幾滴溴,有白色煙霧產生。請分別寫出a儀器和c儀器的名稱:_________________________、________________________________。
(2)請寫出a中發生反應的化學方程式:___________________。d中倒置漏斗的作用是:_____,某同學認為如果想驗證該反應的類型,可以取反應后燒杯d中溶液,加入稀硝酸酸化,然后加入硝酸銀溶液,如果產生了淡黃色沉淀即驗證了該反應的類型。試分析該同學的操作是否可行:______(填“是”或“否”),簡要說明其原因:________________________。
(3)液溴滴完后,經過下列步驟分離提純:
①向a中加入10mL水,然后過濾除去未反應的鐵屑;
②濾液依次用10mL水、8mL10%的NaOH溶液、10mL水洗滌。
③向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾。
經以上分離操作后,粗溴苯中還含有的主要雜質為___,要進一步提純,下列操作中必須的是____(填入正確選項前的字母);
A.重結晶 B.過濾 C.蒸餾 D.萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是重要的有機化工原料。下列關于乙烯的有關說法不正確的是( )
A.一種植物生長調節劑B.易燃
C.能使溴水、酸性高錳酸鉀溶液褪色D.與甲烷互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為部分元素在元素周期表中的相對位置。據此回答相關問題:

(1)其中非金屬性最強的是__________(填元素符號)。
(2)P、S兩種元素的最高價氧化物對應的水化物的酸性:H3PO4________H2SO4(填“>”、“<”或“=”)
(3)N位于元素周期表中的第___________族。
(4)F、Cl兩種元素氫化物的穩定性:HF_______HCl(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究碳、氮的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
(1)乙醇是一種重要的燃料,工業上利用乙烯制酒精:C2H4(g)+H2O(l)=C2H5OH(l) ΔH,已知乙烯、乙醇的燃燒熱分別是1411.0kJ·mol-1、1366.8 kJ·mol-1,則ΔH=_____________。
(2)用Cu2Al2O4作催化劑,一定條件下發生反應:CO2(g)+CH4(g)![]() CH3COOH(g),溫度與催化劑的催化效率和乙酸的生成速率的關系如圖,回答下列問題:
CH3COOH(g),溫度與催化劑的催化效率和乙酸的生成速率的關系如圖,回答下列問題:
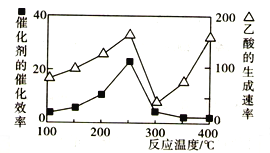
①200~250℃時,乙酸的生成速率升高的主要原因是____________________________。
②300~400℃時,乙酸的生成速率升高的主要原因是____________________________。
(3)甲醇作為一種重要的化工原料。在一定條件下可利用甲醇羰基化法制取甲酸甲酯,其反應原理可表示為CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH=-29.1kJ/mol。向體積為1L的密閉容器中充入3mol CH3OH(g)和3mol CO(g),測得容器內的壓強(p: kPa) 隨時間(t: min) 的變化關系如圖中Ⅰ、Ⅱ、Ⅲ曲線所示:
HCOOCH3(g) ΔH=-29.1kJ/mol。向體積為1L的密閉容器中充入3mol CH3OH(g)和3mol CO(g),測得容器內的壓強(p: kPa) 隨時間(t: min) 的變化關系如圖中Ⅰ、Ⅱ、Ⅲ曲線所示:
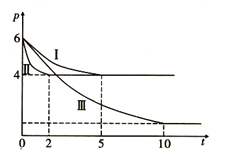
①Ⅱ和Ⅰ相比,Ⅱ中改變的反應條件是_______________________。
②Ⅲ和Ⅰ相比,Ⅲ中改變的反應條件是_________________,判斷的理由是________________________。
③反應Ⅰ在5min 時達到平衡,在此條件下從反應開始到達到平衡時v(CH3OH)= ________________。
④反應Ⅱ在2min 時達到平衡,平衡常數K(Ⅱ)= ______________。在體積和溫度不變的條件下,在上述反應達到平衡Ⅱ時,再往容器中加入2mol CH3OH 和1mol HCOOCH3后,平衡_______移動(填“正向”“逆向”或“不”),原因是____________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com