
【題目】(1)乙基叔丁基醚(以ETBE表示)是一種性能優良的高辛烷值汽油調和劑。用乙醇與異丁烯(以IB表示)在催化劑HZSM-5催化下合成ETBE,反應的化學方程式為:C2H5OH(g)+IB(g)![]() ETBE(g) △H。回答下列問題:
ETBE(g) △H。回答下列問題:
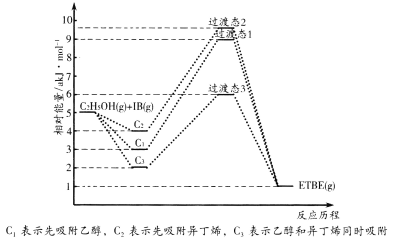
反應物被催化劑HZSM-5吸附的順序與反應歷程的關系如圖所示,該反應的△H=__kJ·mol-1。反應歷程的最優途徑是__(填C1、C2或C3)。
(2)一定條件下,用Fe2O3、NiO或Cr2O3作催化劑對燃煤煙氣回收。反應為2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH=-270kJ·mol-1
2CO2(g)+S(l) ΔH=-270kJ·mol-1
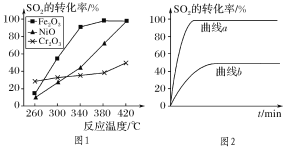
①其他條件相同、催化劑不同,SO2的轉化率隨反應溫度的變化如圖1,Fe2O3和NiO作催化劑均能使SO2的轉化率達到最高,不考慮催化劑價格因素,選擇Fe2O3的主要優點是:__。
②某科研小組用Fe2O3作催化劑。在380℃時,分別研究了[n(CO)∶n(SO2)]為1∶1、3∶1時SO2轉化率的變化情況(圖2)。則圖2中表示n(CO)∶n(SO2)=3∶1的變化曲線為__。
(3)已知NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相應的速率與其分壓關系如圖所示。
N2O4(g) △H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相應的速率與其分壓關系如圖所示。

一定溫度下,k1、k2與平衡常數Kp(壓力平衡常數,用平衡分壓代替平衡濃度計算)間的關系是k1=__;在圖標出點中,指出能表示反應達到平衡狀態的點是__,理由是__。
(4)二氧化硫的催化氧化是工業上生產硫酸的主要反應O2(g)+2SO2(g)![]() 2SO3(g)。
2SO3(g)。
已知:標準平衡常數Kθ=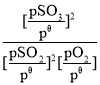 ,其中pθ為標準壓強(1×105Pa),p(SO3)、p(O2)和p(SO2)為各組分的平衡分壓,如p(SO3)=x(SO3)p,p為平衡總壓,x(SO3)為平衡系統中SO3的物質的量分數。
,其中pθ為標準壓強(1×105Pa),p(SO3)、p(O2)和p(SO2)為各組分的平衡分壓,如p(SO3)=x(SO3)p,p為平衡總壓,x(SO3)為平衡系統中SO3的物質的量分數。
SO2和O2起始物質的量之比為2:1,反應在恒定溫度和標準壓強下進行,SO3的平衡產率為ω,則Kθ=___(用含ω的最簡式表示)。
【答案】-4a C3 Fe2O3作催化劑時,在相對較低的溫度可獲得較高的SO2轉化率,從而節約能源 a k1=2k2·KP BD 達到平衡時,N2O4與NO2的消耗速率滿足條件v(NO2)=2v(N2O4) ![]()
【解析】
(1)由圖可知,反應物總能量大于生成物總能量,為放熱反應,由圖給數據可計算△H;活化能的大小可以反映化學反應發生的難易程度,活化能越小,反應越容易進行;
(2)①Fe2O3作催化劑時,在相對較低溫度可獲得較高SO2的轉化率,從而節約大量能源;
②n(CO):n(SO2)=2:1時反應速率界于n(CO):n(SO2)=3:1和n(CO):n(SO2)=1:1之間,反應速率介于二者之間,且二氧化硫的轉化率和n(CO):n(SO2)=3:1是相等的;
(3)當反應達到平衡時,正逆反應速率相等,NO2與N2O4的消耗速率的關系為v(NO2)=2v(N2O4),則k1p2(NO2)=2k2p(N2O4);滿足平衡條件v(NO2)=2v(N2O4)即為平衡點,B、D點的壓強之比等于其反應速率之比為1:2;
(4)設SO2和O2起始物質的量為2mol和1mol,由SO3的平衡產率為ω可知,平衡時SO3的物質的量為2ω,由題意建立三段式計算可得。
(1)由圖可知,反應物總能量大于生成物總能量,為放熱反應,則該反應的△H=—(5—1)akJ/mol=—4 akJ/mol;活化能的大小可以反映化學反應發生的難易程度,過渡態1和2的活化能都為6akJ/mol,過渡態3的活化能為4akJ/mol,活化能越小,反應越容易進行,過渡態3的活化能最小,反應歷程最優,故答案為:-4a;C3;
(2)①根據圖示內容,對比260℃時不同催化劑作用下SO2的轉化率,可以看出Cr2O3作催化劑時,反應速率最快,Fe2O3和NiO作催化劑均能使SO2的轉化率達到最高,但是Fe2O3作催化劑時,在相對較低溫度可獲得較高SO2的轉化率,從而節約大量能源,故答案為:Fe2O3作催化劑時,在相對較低溫度可獲得較高SO2的轉化率,從而節約大量能源;
②n(CO):n(SO2)=2:1時反應速率界于n(CO):n(SO2)=3:1和n(CO):n(SO2)=1:1之間,反應速率介于二者之間,且二氧化硫的轉化率和n(CO):n(SO2)=3:1是相等的,Fe2O3作催化劑時,曲線a符合,故答案為:a;
(3)反應的化學平衡常數Kp=![]() ,當反應達到平衡時,正逆反應速率相等,NO2與N2O4的消耗速率的關系為v(NO2)=2v(N2O4),則k1p2(NO2)=2k2p(N2O4),k1=2k2·KP;滿足平衡條件v(NO2)=2v(N2O4)即為平衡點,B、D點的壓強之比等于其反應速率之比為1:2,所以B、D為平衡點,故答案為:2k2·KP;BD;
,當反應達到平衡時,正逆反應速率相等,NO2與N2O4的消耗速率的關系為v(NO2)=2v(N2O4),則k1p2(NO2)=2k2p(N2O4),k1=2k2·KP;滿足平衡條件v(NO2)=2v(N2O4)即為平衡點,B、D點的壓強之比等于其反應速率之比為1:2,所以B、D為平衡點,故答案為:2k2·KP;BD;
(4)設SO2和O2起始物質的量為2mol和1mol,由SO3的平衡產率為ω可知,平衡時SO3的物質的量為2ω,由題意建立如下三段式:
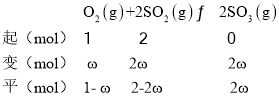
由三段式可得p(SO3)、p(O2)和p(SO![]() ×pθ、
×pθ、![]() ×pθ、
×pθ、![]() ×pθ,則標準平衡常數Kθ=
×pθ,則標準平衡常數Kθ=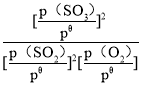 =
=![]() =
=![]() ,故答案為:
,故答案為:![]() 。
。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
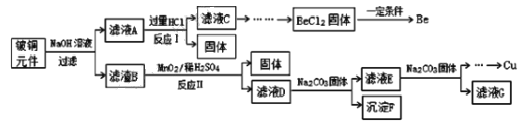
【題目】鈹銅是廣泛應用于制造高級彈性元件的良好合金。某科研小組從某廢舊鈹銅元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收鈹和銅兩種金屬的工藝流程如圖:
已知:
Ⅰ.鈹、鋁元素化學性質相似;
Ⅱ.常溫下部分難溶物的溶度積常數如表:
難溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)濾液A的成分除 NaOH、Na2BeO2外,還有________(填化學式),寫出反應I中Na2BeO2,與過量鹽酸反應的化學方程式:_________________。
(2)從濾液C 中提純純BeCl2,最合理的實驗步驟順序為_________(填字母)
a.加入過量的氨水 b.通入過量 CO2 c.加入過量NaOH溶液 d.加入適量HCl e.洗滌 f.過濾
(3)MnO2能將金屬硫化物中的硫元素氧化為硫單質,寫出反應Ⅱ中CuS發生反應的離子方程式:__________。若用濃HNO3溶解金屬硫化物,缺點是________(任寫一條)
(4)濾液D中c(Cu2+)= 2.2 molL-1、c(Fe3+) = 8.0×10 -3molL-1、c(Mn2+)= 0.01molL-1,逐滴加入 Na2CO3溶液調節pH 可將其轉變成氫氧化物依次分離,首先沉淀的是______ (填離子符號)。為使銅離子開始沉淀,常溫下應調節溶液的pH____4。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.ΔH<0、ΔS>0的反應在溫度低時不能自發進行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自發進行,原因是體系有自發地向混亂度增大的方向轉變的傾向
C.因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨作為反應自發性的判據
D.化學反應的限度不可以通過改變條件而改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上由乙苯生產苯乙烯的反應如下,下列有關說法正確的是 ( )
 +H2
+H2
A.該反應的類型為取代反應
B.苯乙烯分子中所有原子一定在同一平面上
C.乙苯和苯乙烯都能發生氧化反應
D.比乙苯多一個碳原子的同系物R的同分異構體(包含R,不含立體異構)共有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】富馬酸(反式丁烯二酸)與Fe2+形成的配合物——富馬酸亞鐵又稱富血鐵,可用于治療缺鐵性貧血。以下是合成富馬酸亞鐵的一種工藝路線:

回答下列問題:
(1)A的化學名稱為________;由A生成B的反應類型為______。
(2)C的結構簡式為______。
(3)富馬酸的結構簡式為______。
(4)檢驗富血鐵中是否含有Fe3+需要用的試劑是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的的是
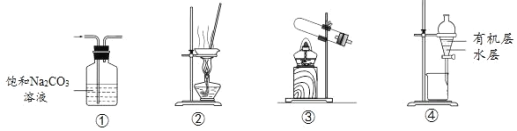
A.用①裝置除去CO2中含有的少量SO2
B.用②裝置蒸干飽和AlCl3溶液制備AlCl3晶體
C.用③裝置加熱NH4Cl固體制取NH3
D.用④裝置分離乙酸乙酯與水的混合液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用Na2SO3溶液吸收硫酸工業尾氣中的SO2,并通過電解方法實現吸收液的循環再生。其中陰、陽離子交換膜組合循環再生機理如圖所示,下列有關說法中正確的是

A.X應為直流電源的正極
B.電解過程中陰極區pH升高
C.圖中的b%<a%
D.SO32-在電極上發生的反應為SO32-+2OH--2e-=SO42-+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的某磁黃鐵礦(主要成分FexS,S為-2價)與100mL鹽酸恰好完全反應(礦石中其他成分不與鹽酸反應),生成3.2g硫單質、0.4molFeCl2和一定量H2S氣體,且溶液中無Fe3+。則下列說法正確的是( )
A.該鹽酸的物質的量濃度為4.0mol·L-1
B.該磁黃鐵礦FexS中,Fe2+與Fe3+的物質的量之比為2:1
C.生成的H2S氣體在標準狀況下的體積為8.96L
D.該磁黃鐵礦中FexS的x=0.85
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】示意圖甲為鋅銅原電池裝置,乙為電解熔融氯化鈉制備金屬鈉的裝置。 下列說法正確的是
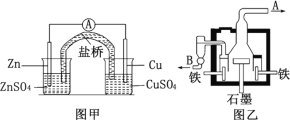
A.甲裝置中鋅為負極,發生還原反應;銅為正極,發生氧化反應
B.甲裝置鹽橋可以使反應過程中溶液保持電中性
C.乙裝置中鐵極的電極反應式為:2Na-2e- = 2Na+
D.乙裝置中 B 是氯氣出口,A 是鈉出口
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com