
【題目】常溫、常壓下,下列各組氣體能共存的是( )
A. NO和O2 B. SO2和O2 C. H2S和SO2 D. NH3和HCl
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種短周期元素,它們的原子序數由A到D依次增大,已知A和C原子最外層只有一個電子,C燃燒時的焰色反應是黃色,C的單質在高溫下與B的單質充分反應可以產生淡黃色固態化合物,A單質與D單質可以發生化合反應,且反應條件可以是點燃或者光照,試根據以上敘述回答:
(1)寫出B、D的元素名稱:BD .
(2)寫出化學方程式:C+B= ,
(3)C元素離子的離子結構示意圖
(4)寫出A2B、C2B2的電子式、 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,有甲、乙兩容器,甲體積可變壓強不變,乙保持體積不變。向兩容器中分別充入1molA、3molB,此時兩容器體積均為500mL,溫度為T℃。保持溫度不變發生反應:A(g)+3B(g) ![]() 2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0
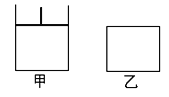
(1)下列選項中,能表明甲和乙容器中反應一定達到平衡狀態的是 。
A.混合氣體的總質量不隨時間改變
B.2 v正(C) = 3v逆(B)
C.A、B轉化率相等
D.物質D的質量不隨時間改變
(2)2min后甲容器中反應達到平衡,測得C的濃度為2mol/L,此時甲容器的體積為_______mL。
(3)當甲乙兩容器中反應都達平衡時,甲和乙中B的轉化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它條件不變,甲中如果從逆反應方向開始反應建立平衡,要求平衡時C的物質的量與(2)中平衡時C的物質的量相等,則需要加入C的物質的量n(C)=________mol,加入D的物質的量n(D)應該滿足的條件為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】滴定原理在中學化學實驗中有著極為重要的應用,現欲采用滴定的方法測定樣品中硫酸亞鐵的質量分數(約45%),根據反應:
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步驟如下:
①稱量樣品3.0 g配成100 mL溶液;
②取20.00 mL待測液,置于錐形瓶中,再加入適量硫酸;
③將0.1 mol/L的標準KMnO4溶液裝入滴定管,調節液面至a mL處(見下圖);

④滴定待測液至滴定終點時,滴定管液面讀數為6;
⑤重復滴定2~3次;
⑥計算。
(1)實驗步驟③中的溶液體積讀數為________mL。
(2)實驗步驟①、③中還需要使用的最主要的儀器分別為:①________、③________。
(3)在步驟④的滴定操作中是否需要在待測液中加入指示劑________。(填“是”或“否”)
(4)若滴定時每次消耗KMnO4溶液體積的平均值為V mL,則綠礬樣品的純度為________。(列出算式即可)如果步驟③中讀數時俯視,則最終結果________。(填“偏大”、“不變”或“偏小”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對1mol·L-1的Na2SO4溶液敘述正確的是
A. 溶液中含有1mol Na2SO4 B. 1mol Na2SO4溶于1L水中
C. 可與1mol·L-1 BaCl2溶液完全反應 D. 1L溶液中含142g Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向體積為2L的容器中加入1mol N2和6mol H2進行可逆反應:N2+3H22NH3 , 2min后測得N2的物質的量為0.6mol,則:
(1)2min內,N2的物質的量減少了0.4mol,H2的物質的量減少了mol,NH3的物質量增加了mol.
(2)若用N2的濃度變化來表示該反應的反應速率,則v(N2)=mol/(Lmin).
(3)若用H2的濃度變化來表示該反應的反應速率,則v(H2)=mol/(Lmin).
(4)若用NH3的濃度變化來表示該反應的反應速率,則v(NH3)=mol/(Lmin).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能夠充分說明在恒溫恒容下的密閉容器中,反應2SO2(g)+O2(g)![]() 2SO3(g)已達平衡狀態的標志是( )
2SO3(g)已達平衡狀態的標志是( )
A. 容器中SO2、O2、SO3的物質的量之比為2∶1∶2
B. SO2和SO3的物質的量濃度相等
C. 反應容器內壓強不隨時間變化而變化
D. 單位時間內生成2 mol SO2時,也生成1 mol O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO與Cl2在常溫常壓下合成。已知NOCl是一種紅褐色液體或黃色氣體,其熔點64.5℃,沸點5.5℃,遇水易水解。
(1)實驗室制備原料氣NO和Cl2的裝置如下圖所示:

①實驗室制NO時,裝置A中燒瓶內發生反應的化學方程式為_______。
②實驗室制Cl2時,裝置B中盛放的試劑為________,其作用是________。
(2)將上述收集到的Cl2充入集氣瓶中,按圖示裝置制備亞硝酰氯。
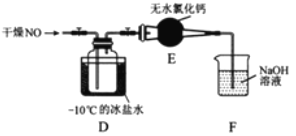
①NOCl分子中各原子均滿足8電子穩定結構,則NOCl的電子式為________。
②裝置D中的現象為________。
③裝置E中無水氯化鈣的作用為________。
④某同學認為裝置F不能吸收NO,為解決這一問題,可將尾氣與某種氣體同時通入氫氧化鈉溶液中,這種氣體的化學式是________。
(3)NO可用間接電化學法除去,其原理如下圖所示:

①陰極的電極反應式為______________________。
②吸收塔內發生反應的離子方程式為_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com