
【題目】將濃度為0.1mol·L-1HF溶液加水不斷稀釋,下列各量始終保持增大的是
A.c(H+)B.Ka(HF)C.c(F-)/c(H+)D.c(F-)/c(HF)
科目:高中化學 來源: 題型:
【題目】以乙烷燃料電池為電源進行電解的實驗裝置如圖所示。下列說法正確的是
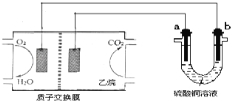
A.燃料電池工作時,正極反應為O2+2H2O+4e-═ 4OH-
B.a極是銅,b極是鐵時,硫酸銅溶液濃度減小
C.a、b兩極若是石墨,在同溫同壓下a極產生的氣體與電池中消耗的乙烷體積的比為7/2
D.a極是純銅,b極是粗銅時,a極上有銅析出,b極逐漸溶解,兩極質量變化相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,濃度均為0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判斷不正確的是( )
A.均存在電離平衡和水解平衡
B.存在的粒子種類不同
C.c(OH-)前者小于后者
D.分別加入NaOH固體,恢復到原溫度,c(CO32-)均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,相同pH的鹽酸和醋酸溶液分別加水稀釋,平衡pH隨溶液體積變化的曲線如圖所示。據圖判斷不正確的是
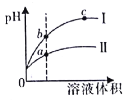
A.I是鹽酸,II是醋酸
B.b點酸的總濃度大于a點酸的總濃度
C.溶液的導電性a>b>c
D.a、b、c三點KW的數值相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表實驗中,對應的現象和結論都正確,且兩者具有因果關系的是( )
選項 | 實驗 | 現象 | 結論 |
A | 將少量碳酸鈣粉末加入到飽和NH4Cl溶液中 | 產生氣體,粉末溶解 | NH4Cl水解使溶液呈酸性 |
B | 將BaSO4固體粉末加入飽和Na2CO3溶液中,攪拌,過濾,洗滌,在濾渣中加入稀鹽酸 | 產生氣體,濾渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
C | 將黑色氧化銅粉末進行高溫加熱 | 黑色變成紅色 | CuO分解生成銅單質 |
D | 將某溶液滴加過量的稀鹽酸 | 有刺激性氣味氣體產生,溶液中出現沉淀 | 溶液中一定存在S2-和SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1100℃,一定容積的密閉容器中發生反應:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) △H=a kJ/mol(a >0),該溫度下K=0.263,下列有關該反應的說法正確的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),該溫度下K=0.263,下列有關該反應的說法正確的是( )
A. 若生成1 mol Fe,則吸收的熱量小于a kJ
B. 若升高溫度,正反應速率加快,逆反應速率減慢,則化學平衡正向移動
C. 若容器內壓強不隨時間變化,則可以判斷該反應已達到化學平衡狀態
D. 達到化學平衡狀態時,若c(CO)=0.100 mol/L,則c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH4Al(SO4)2是食品加工中最為快捷的食品添加劑,用于焙烤食品中;NH4HSO4在分析試劑、醫藥、電子工業中用途廣泛。請回答下列問題:
(1)NH4Al(SO4)2可作凈水劑,其理由是_____________________________(用必要的化學用語和相關文字說明)。
(2)相同條件下,0.1 mol·L-1NH4Al(SO4)2中c(![]() )________0.1 mol·L-1NH4HSO4中c(
)________0.1 mol·L-1NH4HSO4中c(![]() )。(填“等于”、“大于”或“小于”)
)。(填“等于”、“大于”或“小于”)
(3)用等式表示0.1 mol·L-1NH4Al(SO4)2溶液中各離子濃度關系____________。
(4)如圖是0.1 mol·L-1電解質溶液的pH隨溫度變化的圖像。
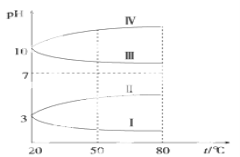
其中符合0.1 mol·L-1NH4Al(SO4)2的pH隨溫度變化的曲線是________(填寫字母),導致pH隨溫度變化的原因是_____________________________;
(5)室溫時,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH與氨水體積的關系曲線如圖所示:

①試分析圖中a、b、c、d四個點,水的電離程度最大的是____________;
②在b點,溶液中各離子濃度由大到小的排列順序是__________________;
③寫出a點混合溶液中下列算式的精確結果(不能近似計算):
c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)電化腐蝕是鋼鐵發生腐蝕的主要原因,當水膜氫離子濃度較小時,主要發生________腐蝕,其負極反應式為____________________,正極反應式為______________________。
(2)將氯化鐵溶液蒸干灼燒得到的固體物質是______;(填化學式,下同)將硫酸鋁溶液蒸干得到的固體物質是___________________ 。
(3)除CaSO4水垢的方法,寫出反應的化學方程式_________________、_________________;熱的純堿溶液洗滌效果更好的原理是_________________________;明礬凈水的離子方程式__________________。
(4)在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可觀察到______________,此反應的離子方程式為_________。將此混合液過濾,濾渣加入2 mL 0.1 mol·L-1的KI溶液,攪拌,可觀察到____,反應的離子方程式為________。
(5)對于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表達式為_______。
2Ag+(aq)+S2-(aq),其Ksp的表達式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物A(![]() )是重要的有機化工原料。由A制備有機化合物F的合成路線(部分反應條件略去)如下圖所示:
)是重要的有機化工原料。由A制備有機化合物F的合成路線(部分反應條件略去)如下圖所示:

(1)A的分子式是______,B含有的官能團的名稱是_________。
(2)D→E的反應類型是_________。
(3)已知G能與金屬鈉反應,則G的結構簡式為________。
(4)寫出E→F的化學方程式:_________。
(5)龍膽酸D的同分異構體有多種,符合下列條件的有___種。寫出其中一種核磁共振氫譜有六組峰的同分異構體的結構簡式:____。
①能發生銀鏡反應;②與FeCl3溶液發生顯色反應;③1mol該物質能與2mol Na2CO3反應。
(6)已知: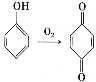 。參照上述合成路線,設計一條以苯酚、乙醇為原料制備龍膽酸乙酯(
。參照上述合成路線,設計一條以苯酚、乙醇為原料制備龍膽酸乙酯(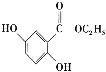 )的合成路線(無機試劑任用)。_________
)的合成路線(無機試劑任用)。_________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com