
【題目】如圖表示兩個常見固氮反應的平衡常數對數值(lgK)與溫度的關系:
①N2+3H22NH3;②N2+O22NO
根據圖中的數據判斷下列說法正確的是( )
A.只有反應①是放熱反應
B.升溫,反應①的速率減小反應②的速率增大
C.可以在常溫下利用反應①進行工業固氮
D.曲線的交點表示反應①和反應②體系中 N2 的轉化率相等
【答案】A
【解析】A、根據圖象①可知溫度越高,平衡常數越小,說明升高溫度,平衡逆向移動,逆反應方向是吸熱反應,則該反應的正反應是放熱反應;②溫度越高,平衡常數越大,說明升高溫度,平衡正向移動,正反應方向是吸熱反應,故A符合題意;
B.升高溫度,無論是放熱反應還是吸熱反應,反應速率都增大,故B不符合題意;
C.在常溫下,平衡常數雖然很大,但反應速率太慢,不適合工業生產,故C不符合題意;
D.在1000℃時,反應①和反應②體系平衡常數對數值(lgK)相等,而不是N2 的轉化率相等,故D不符合題意;
所以答案是:A.
【考點精析】認真審題,首先需要了解化學平衡狀態本質及特征(化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效)).


 長江作業本同步練習冊系列答案
長江作業本同步練習冊系列答案科目:高中化學 來源: 題型:
【題目】工業上合成氨反應為:N2+3H2![]() 2NH3,回答下列問題:
2NH3,回答下列問題:
(1)反應過程中拆開的化學鍵是_______;
(2)反應放熱,從價鍵角度分析,反應放熱的原因是_______,下列圖像正確的是_______。
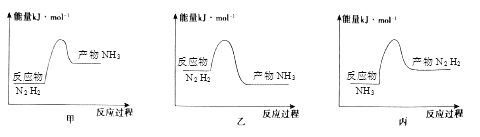
(3)在體積是2L的密閉容器中開始加入1molN2,3molH2,反應過程濃度中,物質的濃度與時間的關系如圖所示。

①t1時生成NH3的物質的量是_______;用H2表示的化學反應速率υ(H2)=_______。
②下列各項能表明反應達到化學平衡狀態的是_______。
A.容器中氣體的密度保持不變
B.容器中氣體的壓強不變
C.氨氣的含量不變
D.拆開3molH—H鍵同時形成6molN—H鍵
(4)下列措施中能提高合成氨反應化學反應速率的是_______。
A.使用高效催化劑 B.恒溫恒容再充入氫氣 C.降低反應溫度 D.擴大容器體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
I. 利用反應:6NO2 + 8NH3![]() 7N2 + 12 H2O處理NO2。
7N2 + 12 H2O處理NO2。
II. 一定條件下NO2與SO2可發生反應:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q (Q>0) 。
SO3(g)+NO(g) Q (Q>0) 。
III. CO可用于合成甲醇,反應方程式為:CO(g) + 2H2(g)![]() CH3OH(g) 。
CH3OH(g) 。
(1)硫離子最外層電子的電子排布式為__________________,氨氣分子的電子式為___________,氨氣分子屬于___________分子(填“極性”或者“非極性”)。
(2)C、O、S、N這四種元素中屬于同周期元素的非金屬性由強到弱的順序為_______________,能證明其遞變規律的事實是(________)
a、最高價氧化物對應水化物的酸性 b、氣態氫化物的沸點
c、單質與氫氣反應的難易程度 d、其兩兩組合形成的化合物中元素的化合價
(3)對于I中的反應,120℃時,該反應在一容積為2L的容器內反應,20min時達到平衡,10min時電子轉移了1.2mol,則0~10min時,平均反應速率υ(NO2) =_______________。
(4)對于II中的反應,將NO2與SO2以體積比1:2置于密閉容器中反應,下列能說明反應達到平衡狀態的是_____________
a. 體系壓強保持不變 b. NO2濃度保持不變
c. NO2和SO3的體積比保持不變 d. 混合氣體的平均相對分子質量保持不變
(5)請寫出II中反應的平衡常數表達式K=_____________________________________。如果II中反應的平衡常數K值變大,該反應___________
a.一定向正反應方向移動 b. 平衡移動時,正反應速率先減小后增大
c.一定向逆反應方向移動 d. 平衡移動時,逆反應速率先增大后減小
(6)對于III中的反應,CO在不同溫度下的平衡轉化率與壓強的關系如圖示。實際生產條件控制在250℃、1.3×104 kPa左右,簡述選擇此壓強的理由:____________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向濃度為 0.1mol/L、體積為 V L 的氨水中逐滴加入 0.1mol/L 的鹽酸,下列 各選項中數值變大的有( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組為研究電化學原理,設計如圖裝置。下列敘述不正確的是

A. a和b不連接時,鐵片上會有金屬銅析出
B. a和b用導線連接時,銅片上發生的反應為Cu2+ + 2e = Cu
C. a和b用導線連接后,溶液中的Cu2+向銅電極移動
D. a和b用導線連接后,Fe片上發生還原反應,
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研機構以納米Fe2O3作為電極材料制備鋰離子電池另一極為金屬鋰和石墨的復合材料,電解質只傳導鋰離子,通過在寶溫條件下對鋰離于電池進行循環充放電,成功實現了對磁性的可逆調控(見圖)。下列說法正確的是

A. 電解質可以用Li2SO4溶液
B. 充電時,Fe作為陰極,電池不被磁鐵吸引
C. 放電時,正極反應為Fe2O3+6Li++6e-==2Fe+3Li2O
D. 充電時,陰極反應為:Li2O +2e-==2Li+O2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻鐵礦的成分主要為FeCr2O4,另含有少量Al2O3和SiO2。從鉻鐵礦中提取鐵、鉻的化合物,并獲得副產物的工藝流程如下:
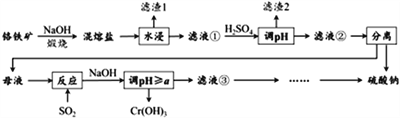
已知“混熔鹽”中含有Na2CrO4和NaFeO2等成分,其中NaFeO2極易水解。試回答下列問題:
(1)“濾渣1”為紅褐色沉淀,其化學式為_________________;通過水浸生成紅褐色沉淀的化學方程式為_________________________________。
(2)向濾液①中加H2SO4“調“pH”的目的:一是使CrO42-轉化為Cr2O72-,離子方程式為___________________________________;二是____________________________。
(3)“煅燒”鉻鐵礦時,主要成分反應的化學方程式為____________________________。
(4)根據下圖溶解度(S)~溫度(T)曲線判斷,對濾液②進行的最佳“分離”方法為_____________(填序號)。
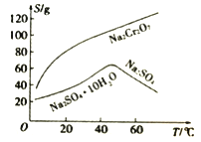
A.蒸發結晶 B.蒸發濃縮,趁熱過濾 C.蒸發濃縮,冷卻結晶,過濾
(5)“反應”的離子方程式為____________________________。
(6)Cr(OH)3溶于鹽酸生成配離子[CrCln(H2O)6-n]x+。0.0015mol[CrCln(H2O)6-n]x+與氫離子交換樹脂(HR)完全發生離子交換:[CrCln(H2O)6-n]x++xHR→Rx[CrCln(H2O)6-n] +xH+,生成的H+可與25.00mL 0.1200mol/L NaOH溶液恰好中和。則該配離子的化學式為__________________。
(7)已知25℃時,Cr(OH)3的溶度積常數Ksp[Cr(OH)3]=1.0×10-32。則使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L時,應調節pH的最小值a為多少___________?(列式計算)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com