
【題目】向1L的密閉容器中加入1molX、0.3molZ和一定量的Y三種氣體。一定條件下發生反應,各物質的濃度隨時間的變化如圖甲所示。圖乙為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件。下列說法不正確的是( )
圖甲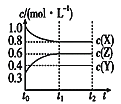 圖乙
圖乙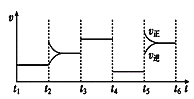
A.t4時改變的條件為增大容器容積以減小壓強
B.該反應的化學方程式為2X(g)+Y(g)![]() 3Z(g) ΔH>0
3Z(g) ΔH>0
C.若t0 =0,t1=10s,則t0~t1階段的平均反應速率為υ(Y)=0.03mol·L-1·s-1
D.反應物X的轉化率t6點比t4點高
【答案】C
【解析】
由圖甲可知X為反應物,Z為生成物, X的濃度變化量為1.0mol/L-0.8mol/L=0.2mol/L,Z的濃度的變化0.6mol/L-0.3mol/L=0.3mol/L,X與Z的化學計量數之比為2:3;圖乙為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件,根據圖乙,t2時改變的條件為增大某物質的濃度;t3時改變條件正、逆反應速率都加快,但平衡不移動,則改變的條件為使用催化劑;t4時改變條件正、逆反應速率都減慢,但平衡不移動,則改變的條件為減小壓強,且反應前后氣體的體積不變,因此Y為反應物,反應方程式為2X(g)+Y(g)![]() 3Z(g);t5改變條件,正、逆反應速率都加快,平衡正向移動,則改變的條件為升高溫度且正反應為吸熱反應。
3Z(g);t5改變條件,正、逆反應速率都加快,平衡正向移動,則改變的條件為升高溫度且正反應為吸熱反應。
由圖甲可知X為反應物,Z為生成物, X的濃度變化量為1.0mol/L-0.8mol/L=0.2mol/L,Z的濃度的變化0.6mol/L-0.3mol/L=0.3mol/L,X與Z的化學計量數之比為2:3;圖乙為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件,根據圖乙,t2時改變的條件為增大某物質的濃度;t3時改變條件正、逆反應速率都加快,但平衡不移動,則改變的條件為使用催化劑;t4時改變條件正、逆反應速率都減慢,但平衡不移動,則改變的條件為減小壓強,且反應前后氣體的體積不變,因此Y為反應物,反應方程式為2X(g)+Y(g)![]() 3Z(g);t5改變條件,正、逆反應速率都加快,平衡正向移動,則改變的條件為升高溫度且正反應為吸熱反應;
3Z(g);t5改變條件,正、逆反應速率都加快,平衡正向移動,則改變的條件為升高溫度且正反應為吸熱反應;
A.根據上述分析,t4時改變的條件為增大容器容積以減小壓強,反應速率減慢,平衡不移動,A項正確;
B.該反應的化學方程式為:2X(g)+Y(g)![]() 3Z(g) ΔH>0,B項正確;
3Z(g) ΔH>0,B項正確;
C. 因濃度的變化量之比等于化學計量數之比,X的濃度變化量為1.0mol/L-0.8mol/L=0.2mol/L,Z的濃度的變化0.6mol/L-0.3mol/L=0.3mol/L,則Y的濃度的變化量為0.1mol/L,υ(Y)=![]() =
=![]() =0.01mol·L-1·s-1,C項錯誤;
=0.01mol·L-1·s-1,C項錯誤;
D. 由圖可知t5-t6為升高溫度,平衡正向移動,因此X的轉化率t6點比t4點高,D項正確;
答案選C。


科目:高中化學 來源: 題型:
【題目】常溫下,下列溶液中的pH判斷或各微粒濃度關系,不正確的是( )
A.將![]() 的
的![]() 溶液與
溶液與![]() 溶液充分混合,若混合后溶液的體積為10mL,則混合液的
溶液充分混合,若混合后溶液的體積為10mL,則混合液的![]()
B.將![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等體積混合,混合液pH大于7,則反應后的混合液中:
溶液等體積混合,混合液pH大于7,則反應后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小關系:
大小關系:![]()
D.常溫下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是![]()
A.反應![]() 室溫下不能自發進行,則該反應的
室溫下不能自發進行,則該反應的![]()
B.鉛蓄電池放電過程中,正極質量增加,負極質量減小
C.![]() 下,在
下,在![]() 稀溶液中,加水,
稀溶液中,加水,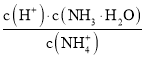 的值不變
的值不變
D.在NaHS溶液中,滴入少量![]() 溶液產生黑色沉淀,
溶液產生黑色沉淀,![]() 水解程度增大,pH增大
水解程度增大,pH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】飲水安全在人們生活中占有極為重要的地位,某研究小組提取三處被污染的水源進行了分析,給出了如下實驗信息:其中一處被污染的水源含有A、B兩種物質,一處含有C、D兩種物質,一處含有E物質。A、B、C、D、E五種常見化合物都是由下表中的離子形成:
陽離子 | K+、Na+、 Cu2+、Al3+ |
陰離子 | SO42-、HCO3-、NO3-、OH- |
為了鑒別上述化合物,分別進行以下實驗,其結果如下所示:
①將它們溶于水后,D為藍色溶液,其他均為無色溶液;
②將E溶液滴入到C溶液中出現白色沉淀,繼續滴加,沉淀溶解;
③進行焰色反應,只有B、C為紫色(透過藍色鈷玻璃片);
④在各溶液中加入硝酸鋇溶液,再加過量稀硝酸,A中放出無色氣體,C、D中產生白色沉淀;
⑤將B、D兩溶液混合,未見沉淀或氣體生成。
根據上述實驗填空:
(1)寫出B、D的化學式:B:____________、D:________。
(2)將含1 mol A的溶液與含1 mol E的溶液反應后蒸干,僅得到一種化合物,該化合物為____________。
(3)寫出實驗②發生反應的離子方程式:___________________、_________________。
(4)C常用作凈水劑,用離子方程式表示其凈水原理:_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖1所示。下列說法正確的是
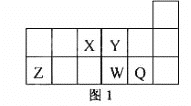
A. 元素X與元素Z的最高正化合價之和的數值等于8
B. 原子半徑的大小順序為:rX>rY>:rZ>rW>rQ
C. 離子Y2-和Z 3+的核外電子數和電子層數都不相同
D. 元素W的最高價氧化物對應的水化物的酸性比Q的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用相同濃度的NaOH溶液分別滴定濃度均為![]()
![]() 的三種酸
的三種酸![]() 、HB和
、HB和![]() 溶液,滴定的曲線如圖所示。下列判斷不正確的是
溶液,滴定的曲線如圖所示。下列判斷不正確的是![]()
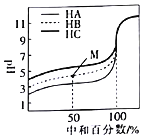
A.三種酸的電離平衡常數:![]()
B.滴定至M點時,溶液中:![]()
![]()
C.![]() 時,三種溶液中:
時,三種溶液中:![]()
![]()
D.當中和百分數達到![]() 時,三種溶液中:
時,三種溶液中:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4mol A氣體和2mol B氣體置于1L的密閉容器中,混合后發生如下反應:2A(g)+B(g)=2C(g)+D(s)。若經2s后測得C的濃度為1.8mol/L,下列說法正確的是
A.2s時物質A的濃度為0.9mol/L
B.用物質D表示的反應速率為0.45mol/(L·s)
C.用物質A表示的反應速率為1.8mol/(L·s)
D.2s時物質B的濃度為1.1mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化硅陶瓷能代替金屬制造發動機的耐熱部件。工業上用化學氣相沉積法制備氮化硅,其反應如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒壓絕熱容器中反應,下列選項表明反應一定已達化學平衡狀態的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒壓絕熱容器中反應,下列選項表明反應一定已達化學平衡狀態的是( )
A. 容器的溫度保持不變 B. 容器的壓強保持不變
C. υ正(N2)=6υ逆(HCl) D. 容器內的氣體c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】東晉《華陽國志南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品。回答下列問題:
(1)鎳元素基態原子的電子排布式為__,3d能級上的未成對的電子數為__。
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。
①[Ni(NH3)6]SO4中陰離子的立體構型是__。
②在[Ni(NH3)6]2+中Ni2+與NH3之間形成的化學鍵稱為__,提供孤電子對的成鍵原子是__。
③氨的沸點___(填“高于”或“低于”)膦(PH3),原因是__;氨是__分子(填“極性”或“非極性”),中心原子的軌道雜化類型為__。
(3)單質銅及鎳都是由__鍵形成的晶體:元素銅與鎳的第二電離能分別為:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是__。
(4)某鎳白銅合金的立方晶胞結構如圖所示。
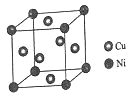
①晶胞中銅原子與鎳原子的數量比為__。
②若合金的密度為dg/cm3,晶胞參數a=__nm。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com