
【題目】如圖,下列各情況,在其中Fe片腐蝕由慢到快的順序是( )

A. ⑤②①③④ B. ⑤①②④③ C. ④②①③⑤ D. ④③①②⑤
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】環己烯常用于有機合成。現通過下列流程,以環己烯為原料合成環醚、聚酯、橡膠,其中F可以做內燃機的抗凍劑,J分子中無飽和碳原子。
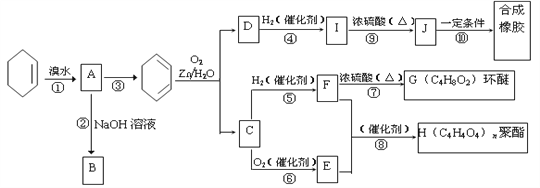
已知:R1-CH=CH-R2 ![]() R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)F的名稱是___________,C中含有的官能團的名稱是______________。
(2)③的反應條件是_________________________。
(3)寫出下列反應類型:⑥_________________,⑨______________。
(4)寫出②反應化學方程式: ____________________________。
(5)寫出⑩反應化學方程式:________________________________________。
(6)試寫出C與新制銀氨溶液反應的化學方程式:_________________________
(7)D的一種同分異構體,可發生加成聚合反應,且能和NaHCO3反應,有三種氫原子,核磁共振氫譜面積比為1:2:3,試寫出結構簡式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2用途很廣,它是一種廣泛應用的氧化劑。例如將它加入熔態的玻璃中,可以除去帶色的雜質(硫化物或亞鐵鹽),稱為普通玻璃的“漂白劑”。在錳-鋅干電池中用作去極劑,以氧化在電極上產生的氫。
(1)Zn- MnO2干電池應用廣泛,其電解質溶液是ZnCl2-NH4Cl混合溶液。其電解質溶液呈________性(填“酸”、“堿”或“中”),原因是_________________、________________(用離子方程式表示);該電池工作時,電子流向__________極(填“正”或 “負”)。
(2)工業上,常以菱錳礦(主要成分MnCO3,常含有少量鐵、鈣、鋅等元素)為原料,用電解法可以制備MnO2。其制備過程如下:

寫出酸浸的主要化學方程式:______________________。
②下圖可以看出,從MnSO4和ZnSO4混合溶液中結晶MnSO4·H2O晶體,需要控制的溫度范圍為______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上

③請寫出用惰性電極電解MnSO4溶液制備MnO2的陽極反應:___________________。
④該工藝產生的廢水中含有較多的Mn2+,通常用H2S或者Na2S溶液處理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl氣體或加入NaOH固體以調節溶液pH,溶液pH與c(S2-)關系如圖(忽略溶液體積的變化、H2S的揮發)。

i.pH=13時,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,當調節溶液pH=5時,Mn2+開始沉淀,則x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A.含有NA個氦原子的氦氣在標準狀況下的體積約為11.2L
B.25℃,1.01×105 Pa,32 g O2和O3的混合氣體所含原子數為2NA
C.標準狀況下,11.2LH2O 含有的分子數為0.5NA
D.在常溫常壓下,44gCO2含有的分子數為3NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com