
| A. | 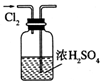 干燥C12 | B. | 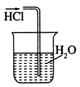 吸收HCl | ||
| C. | 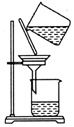 除去粗鹽中的不溶物 | D. | 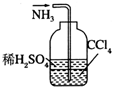 吸收NH3 |
分析 A.干燥時導管應長進短出;
B.HCl極易溶于水,導管在液面下可發生倒吸;
C.過濾時漏斗下端尖端應緊靠燒杯內壁;
D.四氯化碳與水分層,且在下層,隔絕氣體與水.
解答 解:A.干燥時導管應長進短出,圖中氣體的進入方向不合理,故A錯誤;
B.HCl極易溶于水,導管在液面下可發生倒吸,圖中裝置可發生倒吸,故B錯誤;
C.過濾時漏斗下端尖端應緊靠燒杯內壁,圖中操作不規范,故C錯誤;
D.四氯化碳與水分層,且在下層,隔絕氣體與水,則圖中裝置可吸收NH3,并能防止倒吸,故D正確;
故選D.
點評 本題考查化學實驗方案的評價,為高頻考點,把握實驗裝置的作用、實驗技能、物質的性質、混合物分離提純為解答的關鍵,側重分析與實驗能力的考查,注意實驗的評價性分析,題目難度不大.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:解答題
| 化學反應及平衡常數 | 平衡常數數值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K隨壓強的改變而改變 | B. | K越大,C的平衡濃度越小 | ||
| C. | C的起始濃度越大,K值越大 | D. | K越大,反應進行的程度越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗后剩余的鈉粒,需要放回原試劑瓶中 | |
| B. | 少量的鈉可以保存煤油中,如果露置在空氣中會迅速和氧氣反應生成過氧化鈉 | |
| C. | 鈉長期放罝在空氣中,最終將變成碳酸鈉 | |
| D. | 當鈉與硫酸銅溶液反應時,有大量藍色沉淀出現 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 配制0.10 mol/L CH3 COOH溶液,測溶液的pH,若pH大于1,則可證明醋酸為弱電解質 | |
| B. | 用pH計分別測0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若兩者的pH相差小于1個,則可證明醋酸是弱電解質 | |
| C. | 取等體積等濃度的CH3 COOH和鹽酸溶液,分別加入Na2CO3固體,若醋酸溶液產生氣體多,證明醋酸為弱電解質 | |
| D. | 測相同濃度鹽酸和醋酸的導電性,醋酸溶液的導電性明顯弱于鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCl3═Fe3++Cl3- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | KMnO4═K++Mn7++4O2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性溶液中:Ca2+、Na+、PO43-、NO3- | |
| B. | 0.1 mol•L-1Na2S溶液中:Ag+、Fe3+、NO3-、Cl- | |
| C. | 無色溶液中:K+、H+、Cl-、MnO4- | |
| D. | 0.1 mol•L-1 NaOH溶液中:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 轉化率 壓強 | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com