
【題目】研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)NO2可用水吸收,相應的化學方程式為____________________。利用反應6NO2+8NH3![]() 7N2+12H2O也可處理NO2。當轉移1.2 mol電子時,消耗的NH3在標準狀況下是____L。
7N2+12H2O也可處理NO2。當轉移1.2 mol電子時,消耗的NH3在標準狀況下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定條件下,將NO2與SO2以體積比1∶2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是____(填字母)。
A.體系壓強保持不變 B.混合氣體顏色保持不變
C.SO3和NO的體積比保持不變 D.每消耗1 mol SO3的同時生成1 mol NO2
③測得上述反應平衡時NO2與SO2的體積比為1∶6,則平衡常數K=____。
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)![]() CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。
CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。
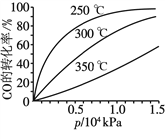
該反應的ΔH ____(填“>”或“<”)0。實際生產條件控制在250 ℃、1.3×104 kPa左右,選擇此壓強的理由是________________。
(4)煤燃燒產生的煙氣也含氮的氧化物,用CH4催化還原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
寫出CH4 催化還原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的熱化學方程式:______。
【答案】 NO2+H2O ═ 2HNO3+NO 8.96 -41.8 B 2.67 < 在250 ℃、1.3×104 kPa下,CO轉化率已較高,再增大壓強,CO轉化率提高不大,而生產成本增加 CH4(g)+N2O4(g) ═ N2(g)+CO2(g)+2H2O(l) ΔH = -898.1 kJ·mol-1
【解析】本題主要考查化學平衡的移動。
(1)NO2可用水吸收,相應的化學方程式為NO2+H2O ═ 2HNO3+NO。NH3~3e-,當轉移1.2 mol電子時,消耗NH30.4mol,在標準狀況下是0.4mol×22.4L/mol=8.96L。
(2)①反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=0.5(-196.6+113.0)kJ·mol-1=-41.8kJ·mol-1。
SO3(g)+NO(g)的ΔH=0.5(-196.6+113.0)kJ·mol-1=-41.8kJ·mol-1。
②A.該反應氣體物質的量無變化,反應過程中壓強一直保持不變,故A不能說明反應達到平衡狀態;B.混合氣體顏色隨著反應進行而發生變化,當混合氣體顏色保持不變時,反應達到平衡狀態,故B能說明反應達到平衡狀態;C.SO3和NO的體積比等于它們的化學計量數之比,SO3和NO的體積比一直保持不變, 故C不能說明反應達到平衡狀態;D.每消耗1molSO3的同時生成1molNO2,都是逆反應速率,故D不能說明反應達到平衡狀態。故選B。
③NO2與SO2起始體積比1∶2,設NO2體積轉化x,測得上述反應平衡時NO2與SO2的體積比為1∶6,則(1-x):(2-x)=1:6,x=0.8,平衡常數K=0.82/(0.2×1.2)=8/3=2.67。
(3)壓強一定時,CO的轉化率隨著溫度升高而減小,說明升溫平衡左移,該反應的ΔH<0。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是在250 ℃、1.3×104 kPa下,CO轉化率已較高,再增大壓強,CO轉化率提高不大,而生產成本增加。
(4)將上述三個熱化學方程式依次用a、b、c代替,a-b+2c得CH4催化還原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的熱化學方程式:CH4(g)+N2O4(g) ═N2(g)+CO2(g)+2H2O(l) ΔH = -898.1 kJ·mol-1。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知1 g氫氣完全燃燒生成液態水時放出熱量143kJ, 18g水蒸氣變成液態水放出44kJ的熱量。其他相關數據如下表:
O=O | H-H | H-O(g) | |
1mol化學鍵斷裂需要吸收的能量/kJ | 496 | 436 | x |
則表中x為
A. 188 B. 463 C. 557 D. 920
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有下列6種離子中的某幾種:Cl﹣、SO42﹣、NH4+、CO32﹣、K+、Na+ . 為確認溶液組成進行如下實驗: ①200mL上述溶液,加入足量BaCl2溶液,反應后將沉淀過濾、洗滌、干燥,得沉淀4.30g,向沉淀中加入過量的鹽酸,有2.33g沉淀不溶.
②向①的濾液中加入足量的NaOH溶液,加熱,產生能促使濕潤紅色石蕊試紙變藍的氣體1.12L(已換算成標準狀況,假定產生的氣體全部逸出).
(1)溶液一定存在的離子有 , 可能存在的離子有;
(2)原溶液中c(CO32﹣)為 , c(NH4+)c(SO42﹣) (填“>、<或=”);
(3)如果上述6種離子都存在,則c(Cl﹣)c(SO42﹣) (填“>、<或=”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ. (1)右圖為1 mol NO2(g)和1 mol CO(g)反應生成NO(g)和CO2(g)過程中的能量變化示意圖。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、 E2為反應的活化能)。若在反應體系中加入催化劑,反應速率增大,則E1、ΔH的變化分別是____、____(填“增大”、“減小”或“不變”)。寫出該反應的熱化學方程式:__。

(2)若反應SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自發進行,則ΔH ___(填字母)0。
A.大于 B.小于 C.等于 D.大于或小于都可
Ⅱ. 以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取乙醇的反應:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH = Q kJ·mol-1 (Q>0)。在密閉容器中,按CO2與H2的物質的量之比為1∶3進行投料,在5 MPa下測得不同溫度下平衡體系中各種物質的體積分數(y%)如圖所示。
CH3CH2OH(g)+3H2O(g) ΔH = Q kJ·mol-1 (Q>0)。在密閉容器中,按CO2與H2的物質的量之比為1∶3進行投料,在5 MPa下測得不同溫度下平衡體系中各種物質的體積分數(y%)如圖所示。

完成下列填空:
(1)表示CH3CH2OH體積分數曲線的是____(填字母)。
(2)其他條件恒定,達到平衡后,能提高H2轉化率的措施是____(填字母)。
A.升高溫度 B.充入更多的H2
C.移去乙醇 D.增大容器體積
(3)圖中曲線a和c的交點R對應物質的體積分數為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源、環境與生產生活和社會發展密切相關。
一定溫度下,在兩個容積均為2 L的密閉容器中,分別發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相關數據如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相關數據如下:
容器 | 甲 | 乙 |
反應物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡時c(CH3OH) | c1 | c2 |
平衡時能量變化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)該反應的平衡常數表達式為K=____;若甲中反應10 s 時達到平衡,則0~10 s內甲中的平均反應速率v(H2)=______。
(3)下列情況能說明該反應一定達到平衡狀態的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 氣體的密度不再隨時間改變
c. CO2和CH3OH的濃度之比不再隨時間改變 d. 氣體的平均相對分子質量不再隨時間改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】茶葉中鐵元素的檢驗可經過以下四個步驟完成,各步驟中選用的實驗用品不能都用到的是( ) 
A.將茶葉灼燒灰化,選用①、②和⑨
B.用濃硝酸溶解茶葉灰并加蒸餾水稀釋,選用④、⑥和⑦
C.過濾得到的濾液,選用④、⑤和⑦
D.檢驗濾液中的Fe3+ , 選用③、⑧和⑩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應中,既有離子鍵、極性鍵、非極性鍵斷裂,又有離子鍵、極性鍵、非極性鍵形成的是
A. NH4Cl+NaOH=NaCl+NH3↑+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3↑
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】始組鳥(pterodactyl adiene)形狀如一只展翅飛翔的鳥,其鍵線式結構表示如圖,其中R1、R2為烷烴基.則下列有關始祖鳥烯的說法中正確的是

A. 始祖鳥烯與乙烯互為同系物
B. 若R1=R2=甲基,則其化學式C12H16
C. 若R1=R2=甲基,則始祖鳥烯的一氯代物有3種
D. 始祖鳥烯既能使酸性高錳酸鉀褪色,也能使溴水褪色,則兩反應的反應類型是相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com