
【題目】在2L恒容密閉容器中投入足量M(s)和一定量的R(g),發生反應為M(s)+R(g)![]() X(g)+Y(g) △H;所得實驗數據如表所示:
X(g)+Y(g) △H;所得實驗數據如表所示:
實驗 | 溫度/℃ | 起始時R的物質的量/mol | 平衡時氣體總物質的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推斷正確的是( )
A.上述反應中,△H<0
B.實驗②中,該反應的平衡常數K=0.5
C.實驗①經4min達到平衡,0~4 min內υ(X)=0.2mol·L-1·min-1
D.實驗③中a=6.00
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】“綠水青山就是金山銀山”,因此研究NOx、SO2等大氣污染物的妥善處理具有重要意義。
(1)燃煤發電廠常利用反應2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=-681.8kJ·mol-1對煤進行脫硫處理來減少SO2的排放。對于該反應,在T℃時,借助傳感器測得反應在不同時間點上各物質的濃度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
0~10min內,平均反應速率υ(O2)__ mol·L-1·min-1;當升高溫度,該反應的平衡常數K_____(填“增大”“減小”或“不變”)。
(2)NOx的排放主要來自于汽車尾氣,有人利用反應C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
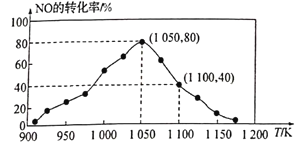
由圖可知,1050K前反應中NO的轉化率隨溫度升髙而增大,其原因為__________;在1100K時,CO2的體積分數為_____。
(3)用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(記作Kp)。在1050K、1.1×106Pa時,該反應的化學平衡常數Kp=___ [已知:氣體分壓(P分)=氣體總壓(Pa)×體積分數]。
(4)為避免汽車尾氣中的有害氣體對大氣的污染,需給汽車安裝尾氣凈化裝置。在凈化裝置中CO和NO發生反應2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成無毒的N2和CO2。實驗測得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成無毒的N2和CO2。實驗測得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數___(填“>”“<”或“=”)k逆增大的倍數。
②若在1L的密閉容器中充入1 molCO和1 molNO,在一定溫度下達到平衡時,CO的轉化率為40%,則![]() =_____。
=_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數值,下列有關敘述正確的是()
A.將78gNa2O2與過量CO2反應轉移的電子數為2NA
B.1molN2與4molH2反應生成的NH3分子數為2NA
C.標準狀況下,2.24LSO3中所含原子數為0.4NA
D.標準狀況下,18gD2O中所含電子數為9NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國古代四大發明之一——黑火藥,它的爆炸反應為2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的電負性從大到小依次為________。
(2)在生成物中,A的晶體類型為________,含極性共價鍵的分子的中心原子軌道雜化類型為________。
(3)已知CN-與N2結構相似,推算HCN分子中σ鍵與π鍵數目之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分。表中所列的字母分別代表一種化學元素。
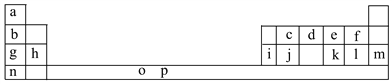
試回答下列問題:
(1)元素p為26號元素,請寫出其基態原子電子排布式:___________________。
(2)d與a反應的產物的分子中中心原子的雜化形式為__________,該分子是__________(填“極性”或“非極性”)分子。
(3)h的單質在空氣中燃燒發出耀眼的白光,請用原子結構的知識解釋發光的原因:__________________________________________________________。
(4)o、p兩元素的部分電離能數據列于下表:
元素 | o | p | |
電離能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比較兩元素的I2、I3可知,氣態o2+再失去一個電子比氣態p2+再失去一個電子難。對此,你的解釋是__________________________________________________;
(5)i單質晶體中原子的堆積方式如下圖甲所示,其晶胞特征如下圖乙所示,原子之間相互位置關系的平面圖如下圖丙所示。
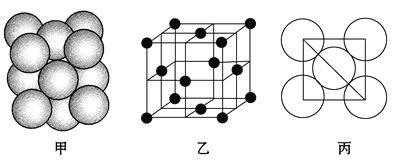
請回答:
①晶胞中i原子的配位數為________,一個晶胞中i原子的數目為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知0.1 mol·L-1的醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中![]() 值增大,可以采取的措施是
值增大,可以采取的措施是
A.加少量燒堿B.降低溫度C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A. 合成氨反應放熱,采用低溫可以提高氨的生成速率
B. 常溫下,將pH=4的醋酸溶液加水稀釋,溶液中所有離子的濃度均降低
C. 反應4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常溫下能自發進行,該反應的ΔH<0
D. 在一容積可變的密閉容器中反應2SO2(g)+O2(g)![]() 2SO3(g)達平衡后,保持溫度不變,縮小體積,平衡正向移動,
2SO3(g)達平衡后,保持溫度不變,縮小體積,平衡正向移動,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖I表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化
B. 圖Ⅱ表示常溫下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲線
C. 圖Ⅲ表示一定質量的冰醋酸加水稀釋過程中,溶液的導電能力變化曲線,圖中a、b、c三點醋酸的電離程度:a<b<c
D. 圖Ⅳ表示反應4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他條件不變的情況下改變起始物CO的物質的量,平衡時N2的體積分數變化情況,由圖可知NO2的轉化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他條件不變的情況下改變起始物CO的物質的量,平衡時N2的體積分數變化情況,由圖可知NO2的轉化率b>a>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外化學興趣小組欲從鋁土礦中提取少量的Al2O3,查閱資料得知,鋁土礦的主要成分是Al2O3,雜質是Fe2O3、SiO2等。從鋁土礦中提取Al2O3的過程如下:
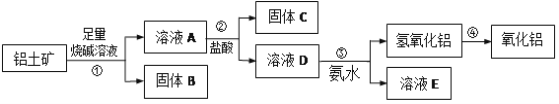
(1)固體B的主要用途為(只寫一種即可)______;
(2)第①步,向鋁土礦中加入足量燒堿溶液,充分反應。發生反應的離子方程式是:______
(3)第③步的實驗操作名稱是______,請簡述洗滌的操作過程______。若往A溶液中通入足量CO2,產生的沉淀為______(填化學式);
(4)工業上制取AlCl3常用Al2O3與炭、Cl2在高溫條件下反應,已知每消耗0.5mol炭單質,轉移1mol電子,則該反應的化學方程式為______
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com