
將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),一定條件下,現有兩個體積均為1.0L恒容密閉容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,發生上述反應并達到平衡。該反應中CO2的平衡轉化率隨溫度的變化曲線如圖所示。下列說法正確的是
CH3OCH3(g)+3H2O(g),一定條件下,現有兩個體積均為1.0L恒容密閉容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,發生上述反應并達到平衡。該反應中CO2的平衡轉化率隨溫度的變化曲線如圖所示。下列說法正確的是
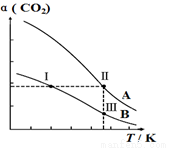
A.反應2CO2(g)+6H2(g) CH3OCH3(g) + 3H2O(g)的 △S<0、△H<0
CH3OCH3(g) + 3H2O(g)的 △S<0、△H<0
B.表 示乙容器CO2的平衡轉化率隨溫度變化的是曲線B
示乙容器CO2的平衡轉化率隨溫度變化的是曲線B
C.體系中c(CH3OCH3):c(CH3OCH3,狀態Ⅱ)<2c(CH3OCH3,狀態Ⅲ)
D.逆反應速率v逆:v逆(狀態Ⅰ)<v逆(狀態Ⅲ)
 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源:2016-2017學年浙江省高二上期中化學試卷(解析版) 題型:選擇題
已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+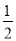 O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
根據以上熱化學方程式判斷,下列說法正確的是( )
A.CO的標準燃燒熱為283 kJ
B.下圖可表示由CO生成CO2的反應過程和能量關系
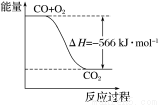
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D.CO(g)與Na2O2(s)反應放出549 kJ熱量時,電子轉移數為6.02×1023
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省淮安市高三12月考試化學試卷(解析版) 題型:選擇題
下列有關說法正確的是
A.鉛蓄電池放電過程中,正負極質量均增加
B.反應NH4Cl (s)=NH3(g)+HCl(g)在室溫下不能自發進行,則該反應的ΔH>0
C.一定條件下,使用催化劑能加快反應速率并提高反應物的平衡轉化率
D.0.1 mol·L-1CH3COOH溶液加水稀釋后,溶液中c(OH-)、CH3COOH濃度均減少
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省七校聯合體高三上學期第二次聯考化學試卷(解析版) 題型:選擇題
下列說法不正確的是
A.將pH=4的某酸稀釋10倍,測得其pH<5,則該酸為弱酸
B.相同pH的CH3COONa、NaOH和Na2CO3三種溶液:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.0.1 mol/L的NaHA溶液pH=5,則溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:
c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三上12月月考化學卷(解析版) 題型:填空題
“低碳循環”引起各國的高度重視,而如何降低大氣中CO2的含量及有效地開發利用CO2,引起了全世界的普遍重視。所以“低碳經濟”正成為科學家研究的主要課題。
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
寫出CO2與H2反應生成CH4和H2O(g)的熱化學方程式 。
(2)將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:
2CO2(g)+6H2(g)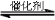 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2)/n(CO2)]的變化曲線如下左圖:

①在其他條件不變時,請在上圖中畫出平衡時CH3OCH3的體積分數隨投料比[n(H2)/n(CO2)]變化的曲線圖。
②某溫度下,將2.0 mol CO2(g)和6.0 mol H2(g)充入容積為2L的密閉容器中,反應到達平衡時,改變壓強和溫度,平衡體系中CH3OCH3(g)的物質的量分數變化情況如下圖所示,關于溫度和壓強的關系判斷正確的是 。

A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的CO和水蒸氣進入反應器時,會發生如下反應:CO(g)+H2O(g) H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
溫度/℃ | 400 | 500 | 800 |
平衡常數K | 9.94 | 9 | 1 |
該反應的平衡常數的表達式為:
該反應的正反應方向是 反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H2O的濃度均為0.020 mol·L-1,在該條件下CO的平衡轉化率為 。
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三上12月月考化學卷(解析版) 題型:選擇題
R、W、X、Y、Z為原子序數依次遞增的同一短周期元素,m、n均為正整數,下列說法正確的是
A. 離子半徑:Rn+>Zm-
B. 若Y的最高價氧化物對應的水化物HnYOm為強酸,則X的氫化物沸點一定比Y的氫化物的沸點低
C. 若X的氣態氫化物能使濕潤的石蕊試紙變藍,則標準狀況下,18g Y的氫化物的體積為2.24 L
D. 若R(OH)n為弱電解質,則W(OH)n+1可與KOH溶液反應
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三上12月月考化學卷(解析版) 題型:選擇題
關于下列各裝置圖的敘述中,錯誤的是
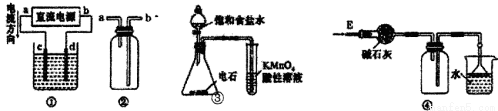
A.裝置①可用于電解飽和食鹽水,c電極產生的氣體能使濕潤的淀粉KI試紙變藍
B.裝置②可用于收集H2、NH3、Cl2、HCl、NO2等氣體
C.裝置③可用于檢查乙炔的還原性
D.裝置④可用于干燥、收集氨氣、并吸收多余的氨氣
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省高三11月階段測化學卷(解析版) 題型:實驗題
KMnO4溶液常用作氧化還原反應滴定的標準液,由于KMnO4的強氧化性,它的溶液很容易被空氣中或水中某些少量還原性物質還原,生成難溶性物質MnO (OH)2,因此配制KMnO4標準溶液的操作是: (1)稱取稍多于所需量的KMnO4固體溶于水,將溶液加熱并保持微沸1h; (2)用微孔玻璃漏斗過濾除去難溶的MnO (OH)2; (3)過濾得到的KMnO4溶液貯存于棕色試劑瓶放在暗處; (4)利用氧化還原滴定方法,在700C-800C條件下用基準試劑 (純度高、式量較大、穩定性較好的物質)溶液標定其濃度。請回答下列問題:
(1)將溶液加熱并保持微沸1h的目的是 。
(2)如何保證在700C~800C條件下進行滴定操作: 。
(3)準確量取一定體積的KMnO4溶液用 (填儀器名稱)。
(4)在下列物質中,用于標定KMnO4溶液的基準試劑最好選用 (填序號)。
A.H2C2O4·2H2O | B.FeSO4 | C.濃鹽酸 | D.Na2SO3 |
(5)若準確稱取Wg你選的基準試劑溶于水配成500mL水溶液,取25.00mL置于錐形瓶中,用高錳酸鉀溶液滴定至終點,消耗高錳酸鉀溶液VmL。問:
①滴定終點標志是 ;
②所配制KMnO4標準溶液的物質的量濃度為 ;
(6)若用放置兩周的KMnO4標準溶液去滴定水樣中Fe2+含量,測得的濃度值將 (填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省高一月考二化學卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是( )
A. 澄清石灰水與少量小蘇打溶液混合: Ca2++2OH-+2HCO3-= CaCO3↓+CO32-+2 H2O
B. 磁性氧化鐵置于氫碘酸溶液中: Fe3O4+8 HI =2Fe3++ Fe2++4 H2O +8I-
C. NaHSO4 溶液中滴加過量 Ba (OH)2溶液: H++SO42-+Ba2++OH-= BaSO4↓+ H2O
D. 用稀硝酸洗滌試管內壁的銀鏡: Ag+2H++NO3-=Ag++ NO↑ H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com