
為探索工業含鋁、鐵、銅合金廢料的再利用,甲同學設計的實驗方案如下:
請回答:
(1)操作①用到的玻璃儀器有 。
(2)寫出反應①的化學方程式: ,反應②的離子反應方程式: 。
(3)設計實驗方案,檢測濾液D中含有的金屬離子(試劑自選) 。
(4)在濾渣E中加入稀硫酸和試劑Y制膽礬晶體是一種綠色化學工藝,試劑Y為無色液體,反應④的總化學方程式是 。
(5)乙同學在甲同學方案的基礎上提出用濾渣B來制備FeCl3·6H2O晶體,在濾渣中滴加鹽酸時,發現反應速率比同濃度鹽酸與純鐵粉反應要快,其原因是 。
將所得氯化鐵溶液用加熱濃縮、降溫結晶法制得FeCl3·6H2O 晶體,而不用直接蒸發結晶的方法來制得晶體的理由是 。
(6)將濾渣B的均勻混合物平均分成四等份,分別加入同濃度的稀硝酸,充分反應后,在標準狀況下生成NO的體積與剩余金屬的質量見下表(設硝酸的還原產物只有NO)。
| 實驗編號 | ① | ② | ③ | ④ |
| 稀硝酸體積(mL) | 100 | 200 | 300 | 400 |
| 剩余金屬質量(g) | 9.0 | 4.8 | 0 | 0 |
| NO體積(L) | 1.12 | 2.24 | 3.36 | V |
 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:填空題
高錳酸鉀(KMnO4)是一種常用的氧化劑。
(1)有下列變化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一個變化與“MnO4-→Mn2+”組成一個反應,寫出該反應的離子方程式: 。
(2)高錳酸鉀可代替二氧化錳用來制取Cl2,則反應中氧化劑和還原劑的物質的量之比為 。
(3)高錳酸鉀與硫化亞鐵有如下反應:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反應前后固體的質量減少了2.8 g,則硫元素與KMnO4之間發生轉移的電子數目為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某工廠對制革工業污泥中Cr元素的回收與再利用工藝如下(硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):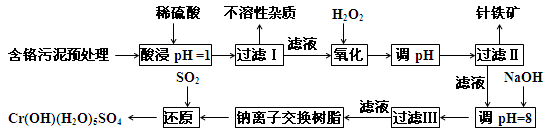
常溫下部分陽離子以氫氧化物沉淀形式存在時溶液的pH見下表:
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
水處理技術在生產、生活中應用廣泛。
(1)工業上常用綠礬作混凝劑除去天然水中含有的懸浮物和膠體,為了達到更好的效果,要將待處理水的pH調到9左右,再加入綠礬。請解釋這一做法的原因:_______________________________________________________________________。
(用必要的離子方程式和文字做答)
(2)根據水中Ca2+、Mg2+的多少,把天然水分為硬水和軟水,硬水必須經過軟化才能使用。①硬水軟化的方法通常有________、________和離子交換法。離子交換樹脂使用一段時間后,逐漸由NaR型變為CaR2(或MgR2)型,而失去交換能力。把CaR2(或MgR2)型樹脂置于________中浸泡一段時間,便可再生。
②當洗滌用水硬度較大時,洗衣粉與肥皂相比,________洗滌效果較好,原因是________________________________________________________________________。
(3)我國某地苯胺大量泄漏于生活飲用水的河道中,當地采取的應急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脫氮工藝進行處理。首先在硝化細菌作用下將NH4+氧化為NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇與NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
試配平以上兩個離子方程式。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
銅是生物體必需的微量元素,也是人類最早使用的金屬之一。銅的生產和使用對國計民生各個方面都產生了深遠的影響。
(1)寫出銅與稀硝酸反應的化學方程式:________________________________________________________________________________________________________________________________________________。
(2)為了保護環境和節約資源,通常先用H2O2和稀硫酸的混合溶液溶出廢舊印刷電路板中的銅,最終實現銅的回收利用。寫出溶出銅的離子方程式:________________________________________________________________________________________________________________________________________________。
(3)工業上以黃銅礦為原料,采用火法熔煉工藝生產銅。該工藝的中間過程會發生反應:2Cu2O+Cu2S 6Cu+SO2↑,該反應的氧化劑是______________;當生成19.2 g Cu時,反應中轉移的電子為__________mol。
6Cu+SO2↑,該反應的氧化劑是______________;當生成19.2 g Cu時,反應中轉移的電子為__________mol。
(4)銅在潮濕的空氣中能發生吸氧腐蝕而生銹,銅銹的主要成分為Cu2(OH)2CO3(堿式碳酸銅)。試寫出上述過程中負極的電極反應式:________________________________________________________________________________________________________________________________________________。
(5)研究性學習小組用“間接碘量法”測定某試樣CuSO4·5H2O(不含能與I-反應的氧化性雜質)的含量。取a g試樣配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。寫出該反應的離子方程式:___________________________。繼續滴加KI溶液至沉淀不再產生,溶液中的I2用硫代硫酸鈉標準溶液滴定,發生反應的化學方程式為I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。則試樣中CuSO4·5H2O的質量分數為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某工業廢水中含有CN-和Cr2O72-等離子,需經污水處理達標后才能排放,污水處理廠擬用下列流程進行處理: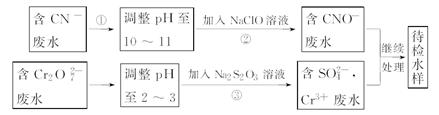
回答下列問題:
(1)上述處理廢水流程中主要采用的方法是_____________。
(2)流程②中,反應后無氣體放出,該反應的離子方程式為_______。
(3)含Cr3+廢水需進一步處理,請你設計一個處理方案:_______。
(4)反應③中,每消耗0.4 mol Cr2O72-轉移2.4 mol e-,該反應離子方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中國氣象局的數據顯示,2013年全國平均霧霾天數為52年來之最。形成霧霾的主要成份為:生產生活中排放的廢氣、汽車尾氣及揚塵等。
(1)用CH4可以消除汽車尾氣中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol
2NO2(g)=N2O4(g) △H=-56.9 kJ/mol
寫出CH4催化還原N2O4(g)生成N2和H2O(l)的熱化學方程式 。
(2)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ/mol,某溫度下,向容積為2L的密閉容器中充入2.0molCO(g)和2.0molH2O(g),在tmin時達到平衡,測得放出了32.8kJ熱量,則tmin內用H2表示的平均反應速率為 ,由此可知在該溫度下反應CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某溫度下,向容積為2L的密閉容器中充入2.0molCO(g)和2.0molH2O(g),在tmin時達到平衡,測得放出了32.8kJ熱量,則tmin內用H2表示的平均反應速率為 ,由此可知在該溫度下反應CO2(g)+H2(g) CO(g)+H2O(g)的化學平衡常數為 。相同條件下,向同一密閉容器中充入1.0molCO2和1.0molH2反應達到平衡后,吸收的熱量為 kJ。
CO(g)+H2O(g)的化學平衡常數為 。相同條件下,向同一密閉容器中充入1.0molCO2和1.0molH2反應達到平衡后,吸收的熱量為 kJ。
(3)堿式硫酸鋁法煙氣脫硫工藝主要有以下三步
①向Al2(SO4)3溶液中投入粉末狀石灰石,生成堿式硫酸鋁[Al2(SO4)3·Al2O3]溶液。
②堿式硫酸鋁吸收SO2,Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3,請寫出Al2(SO4)3·Al2O3與過量燒堿溶液反應的化學方程式 。
③將Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3,可選用氧化劑為 (填代號)
| A.濃硫酸 | B.KMnO4溶液 | C.5%的H2O2溶液 | D.空氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某體系中存在如下反應:
①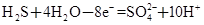 ②
②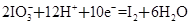
(1)反應①中H2S作_______劑,反應②屬于_______反應。(填“氧化”或“還原”)
(2)若在反應①中失去0.2 mol電子,則反應②中可生成_______g碘。
(3)寫出并配平碘酸鉀與硫化氫反應的化學方程式,同時標出電子轉移的方向和數目:______。
(4)由上述反應可推知_______。
a.氧化性:K2SO4>KIO3 b.酸性:HIO3>H2SO4
c.還原性:H2S>I2 d.反應過程中溶液的酸性逐漸減弱
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
合成氨和制備硝酸是兩種重要的化工生產,重慶某化工廠將合成氨與制備硝酸進行連續生產。
(1)在某溫度下體積為200 L的氨合成塔中,以分為單位的時間點上測得各物質的濃度(mol·L﹣1)如下表:
| | 0 min | l min | 2 min | 3 min | 4 min |
| N2 | 1.500 | 1.400 | 1.200 | c1 | c1 |
| H2 | 4.500 | 4.200 | 3.600 | c2 | c2 |
| NH3 | 0 | 0.200 | 0.600 | c3 | c3 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com