
【題目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取該溶液100 mL,加入過量NaOH溶液,加熱,得到0.02 mol氣體,同時產生紅褐色沉淀;過濾,洗滌,灼燒,得到1.6 g固體;向上述濾液中加足量BaCl2溶液,得到4.66 g不溶于鹽酸的沉淀。由此可知原溶液中( )
A.至少存在5種離子 B.SO42-、NH4+一定存在,Cl-可能不存在
C.Cl-一定存在,且c(Cl-)≥0.4 mol/L D.CO32-、Al3+一定不存在,K+可能存在
【答案】C
【解析】
試題分析:加入過量NaOH溶液,加熱得到氣體,說明原溶液中含有NH4+,即n(NH4+)=0.02mol,同時生成紅褐色沉淀,說明原溶液含有Fe3+。因為CO32-和Fe3+發生水解相互促進的反應,因此原溶液中不含CO32-,灼燒以后得到固體1.6g,即得到Fe2O3的質量為1.6g,則n(Fe3+)=![]() =0.02mol,加入足量的BaCl2溶液,得到不溶于鹽酸的沉淀,說明原溶液中含有SO42-,即n(SO42-)=4.66g÷233g/mol=0.02mol。A、陽離子所帶電荷總數為0.02mol+0.02mol×3=0.08mol,陰離子所帶電荷數為0.02mol×2=0.04mol,即陽離子所帶電荷數大于陰離子,說明原溶液含有Cl-,綜上所述原溶液中至少有4種離子,A錯誤;B、根據上述判斷一定含有Cl-,物質的量至少是0.08mol-0.04mol=0.04mol,此時c(Cl-)=0.04mol÷0.1L=0.4mol·L-1,溶液中可能含有K+、Al3+,則Cl-的濃度將大于0.4mol·L-1,B錯誤;C、根據上述分析可知C正確;D、K+、Al3+可能存在,D錯誤,答案選C。
=0.02mol,加入足量的BaCl2溶液,得到不溶于鹽酸的沉淀,說明原溶液中含有SO42-,即n(SO42-)=4.66g÷233g/mol=0.02mol。A、陽離子所帶電荷總數為0.02mol+0.02mol×3=0.08mol,陰離子所帶電荷數為0.02mol×2=0.04mol,即陽離子所帶電荷數大于陰離子,說明原溶液含有Cl-,綜上所述原溶液中至少有4種離子,A錯誤;B、根據上述判斷一定含有Cl-,物質的量至少是0.08mol-0.04mol=0.04mol,此時c(Cl-)=0.04mol÷0.1L=0.4mol·L-1,溶液中可能含有K+、Al3+,則Cl-的濃度將大于0.4mol·L-1,B錯誤;C、根據上述分析可知C正確;D、K+、Al3+可能存在,D錯誤,答案選C。


科目:高中化學 來源: 題型:
【題目】硼及其化合物在工業上有許多用途.工業上以鐵硼礦為原料制備硼酸,鐵硼礦含有Mg、Fe、Ca、Al、B、O等多種元素,它的主要成分為Mg2B2O5H2O和Fe3O4.
(1)基態鐵原子的外圍電子層排布為______________,該元素位于元素周期表中的第______________族,在水溶液中常以Fe2+、Fe3+的形式存在,其中______________更穩定.
(2)以硼酸為原料可制得NaBH4,B原子的雜化方式為______________。
(3) 第ⅤA族元素的原子R與A原子結合形成RA3氣態分子,其立體結構呈三角錐形.RCl5在氣態和液態時,分子結構如圖所示,下列關于RCl5分子的說法中不正確的是( )

A.分子中5個R-Cl鍵鍵能不都相同
B.鍵角(Cl-R-Cl)有90°、120、180°幾種
C.RCl5受熱后會分解生成分子立體結構呈三角錐形的RCl3
D.每個原子都達到8電子穩定結構
(4)因為氯化鋁易升華,其雙聚物Al2Cl6結構如圖1所示.1mol該分子中含______________個配位鍵,該分子______________(填“是”或“否”)平面型分子.
(5)純疊氮酸(HN3)在常溫下是一種液體,沸點較高,為308. 8 K,主要原因是______________。
(6)二硫化碳屬于_____________ (填“極性”或“非極性”)分子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有甲、乙兩位同學均想利用原電池反應檢測金屬的活動性順序,兩人均使用鎂片和鋁片作電極,但甲同學將電極放入6mol/LH2SO4溶液中,乙同學將電極放入6mol/LNaOH溶液中,如圖:
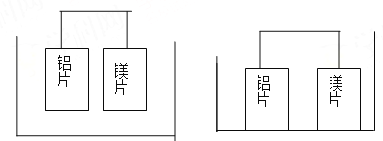
甲(H2SO4溶液) 乙(NaOH溶液)
(1)寫出甲池中正極的電極反應式: ,負極的電極反應式: 。
(2)寫出乙池中負極的電極反應式: ,乙池中總反應的離子方程式: 。
(3)如果甲和乙同學均認為,“構成原電池的電極材料如果都是金屬,則構成負極材料的金屬應比構成正極材料的金屬活潑”,則甲會判斷出 活動性更強,而乙會判斷出 活動性更強。
(5)丙同學依據甲、乙同學的思路,設計如下實驗:將鋁片和銅片用導線相連.一組插入濃硝酸中,一組插入稀NaOH溶液中,分別形成了原電池。
①在這兩個原電池中,負極分別為________。
A.鋁片、銅片 B.銅片、鋁片 C.鋁片、鋁片 D.銅片、銅片
②寫出插入濃硝酸中形成原電池的總反應化學方程式__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃料電池將是21世紀獲得電能的重要途徑。近幾年開發的丁烷燃料電池是采用鉑作電極催化劑,電池中的質子交換膜只允許質子和水分子通過。其工作原理的示意圖如下:

請回答下列問題:
(1)Pt(b)電極是電池的________極,電極反應式為_____________________________;Pt(a)電極發生________反應(填“氧化”或“還原”),電極反應式為____________。
(2)若電解質溶液改為KOH溶液,Pt(b)電極的電極反應式為_____________;Pt(a)電極的電極反應式為_____________________________________________________________。
(3)如果該電池工作時電路中通過1.2 mol電子,則消耗掉O2在標準狀況下的體積為________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在體積不變的絕熱密閉容器中,2molSO2與1molO2在催化劑作用下發生反應:2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol(Q>0)。當氣體的物質的量減少0.5mol時反應達到平衡。下列敘述錯誤的是( )
2SO3(g)△H=﹣QkJ/mol(Q>0)。當氣體的物質的量減少0.5mol時反應達到平衡。下列敘述錯誤的是( )
A.增大氧氣濃度,平衡正向移動,平衡常數不變
B.降低溫度,正反應速率比逆反應速率減小的程度小
C.平衡時SO2氣體的轉化率為50%
D.該條件下反應放出0.5QkJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究碳、氮等單質和化合物的反應有重要意義。
(1)有科學家提出可利用FeO吸收和利用CO2,相關熱化學方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反應中每生成1 mol Fe3O4,轉移電子的物質的量為_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,則反應:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)工業生產可以用NH3(g)與CO2(g)經兩步反應生成尿素〔CO(NH2)2〕,兩步反應的能量變化示意圖如下:
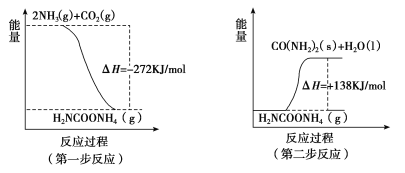
則NH3(g)與CO2(g)反應生成尿素的熱化學方程式為____________________。
(3)氨氣在純氧中燃燒,生成一種單質和水,科學家利用此原理,設計成氨氣一氧氣燃料電池,則通入氨氣的電極是 (填“正極”或“負極”);堿性條件下,該電極發生反應的電極反應式為 。
(4)華盛頓大學的研究人員研究出一種方法,可實現水泥生產時CO2零排放,其基本原理如圖所示:
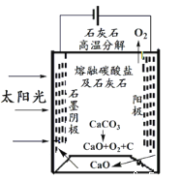
①上述生產過程的能量轉化方式是_____________。
a、電能轉化為化學能
b、太陽能轉化為電能
c、太陽能轉化為化學能
d、化學能轉化為電能
②上述電解反應在溫度小于 900℃時進行,碳酸鈣先分解為CaO和CO2,電解質為熔融碳酸鈉,陰極反應式為3CO2+4e-=C+2CO32-,則陽極的電極反應式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學用如圖所示裝置研究電化學原理。下列關于該原電池的說法不正確的是

A. 原電池的總反應為 Fe+Cu2+=Fe2++Cu
B. 反應前,電極質量相等,一段時間后,兩電極質量相差12 g,導線中通過0.2 mol電子
C. 其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極反應式為2H++2e-=H2↑
D. 鹽橋中是 KNO3溶液,則鹽橋中NO3-移向乙燒杯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在催化劑作用下,CO2和H2可以制取甲醇.用工業廢氣中的CO2可制取甲醇,其反應為:CO2+3H2![]() CH3OH+H2O 常溫常壓下已知下列反應的能量變化如圖示:
CH3OH+H2O 常溫常壓下已知下列反應的能量變化如圖示:

寫出由二氧化碳和氫氣制備甲醇的熱化學方程式: .
(2)硼氫化鈉(NaBH4)是有機合成中的重要還原劑.最新研究發現,以NaBH4(硼元素的化合價在該過程中不發生變化)和H2O2為原料,NaOH溶液作電解質溶液,可以設計成全液流電池,其工作原理如圖所示,假設電池工作前左右兩槽溶液的體積各為1L,回答下列問題:

電極b為 (填“正極”或“負極”),
電極a上發生反應的電極反應式為 .
(3)電池工作時,Na+向 極(填“a”或“b”)移動,
當左槽產生0.0125mol BO2﹣離子時,右槽溶液c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰化鈉是一種重要的基本化工原料,同時也是一種劇毒物質,嚴重危害人類健康。 旦泄露需要及時處理,一般可以通過噴灑雙氧水或硫代硫酸鈉溶液來處理,以減輕環境污染。
I.已知:氰化鈉化學式為NaCN,氰化鈉是一種白色結晶顆粒,劇毒,易溶于水,水溶液呈堿性,易水解生成氰化鈉
(1) CN-中C元素顯+2價,N元素顯-3價,則非金屬性N_______C(填“﹤”“﹥”或“=”),請設計實驗證明: 。
(2) NaCN用雙氧水處理后,產生一種酸式鹽和一種能使濕潤紅色石蕊試紙變藍的氣體,該反應的離子方程式是 。
(3) 氰化鈉與硫代硫酸鈉的反應為:NaCN+Na2S2O3==NaSCN+ Na2SO3;已知:NaSCN中S為-2價,處理1mol NaCN,反應中轉移電子的物質的量為 。
Ⅱ.某化學興趣小組在實驗室制備硫代硫酸鈉(Na2S2O3),并檢測用硫代硫酸鈉溶液處理后的氰化鈉廢水能否達標排放。
【實驗一】實驗室通過如右圖所示裝置制備Na2S2O3。

(4)b裝置的作用是________________。c裝置中的產物有Na2S2O3和CO2等,d裝置中的溶質有NaOH、Na2CO3,還可能有________________________。
(5)實驗結束后,在e處最好連接盛______________(選填“NaOH溶液”、“水”、“CCl4”中任一種)的注射器,然后再__________________,最后拆除裝置。
【實驗二】測定用硫代硫酸鈉溶液處理后的廢水中氰化鈉的含量。
已知:①廢水中氰化鈉的最高排放標準為0.50 mg/L。
②![]() AgI呈黃色,且CN -優先與Ag+反應。
AgI呈黃色,且CN -優先與Ag+反應。
實驗如下:取20.00 mL處理后的氰化鈉廢水于錐形瓶中,并滴加幾滴KI溶液作指示劑,用1.000 ×
10-4 mol/L的標準AgNO3溶液滴定,消耗AgNO3溶液的體積為1.50 mL。
(6)滴定終點的判斷方法是_______________。
(7)處理后的廢水是否達到排放標準____________(填“是”或“否”),寫出判斷依據
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com