
分析 (1)反應相當于Ba(OH)2先與H2SO4反應,然后再Na2SO4與氫氧化鋇反應,100mLBa(OH)2溶液中n[Ba(OH)2]=0.1L×0.2moL•L-1=0.02mol,100mL溶液中n(H2SO4)=0.1L×0.1moL•L-1=0.01mol,故氫氧化鋇與硫酸反應一半,硫酸鈉反應一半,根據n=cV計算硫酸鈉的物質的量,再根據m=nM計算硫酸鈉的質量;
(2)溶液中沉淀量達到最大時,發生Ba2++SO42-=BaSO4↓,故n[Ba(OH)2]=n(SO42-),再根據V=$\frac{n}{V}$計算氫氧化鋇的體積,溶液中溶質為NaOH,根據鈉離子守恒可知n(NaOH)=n(Na+),再根據c=$\frac{n}{V}$計算.
解答 解:(1)反應相當于Ba(OH)2先與H2SO4反應,然后再Na2SO4與氫氧化鋇反應,100mLBa(OH)2溶液中n[Ba(OH)2]=0.1L×0.2moL•L-1=0.02mol,100mL溶液中n(H2SO4)=0.1L×0.2moL•L-1=0.02mol,故氫氧化鋇與硫酸恰好,硫酸鈉不反應,反應的離子方程式為:2H++SO42-+Ba2++2OH-=BaSO4↓+2 H2O,溶液中溶質為Na2SO4,Na2SO4的物質的量為0.1L×0.1moL•L-1=0.01mol,Na2SO4的濃度=$\frac{0.01mol}{0.2L}$=0.05mol/L,
故答案為:Na2SO4;0.05;
(2)溶液中沉淀量達到最大時,硫酸根完全反應,發生Ba2++SO42-=BaSO4↓,故n[Ba(OH)2]=n(SO42-)=0.01mol+0.02mol=0.03mol,故氫氧化鋇溶液的體積為$\frac{0.03mol}{0.2mol/L}$=0.15L=150mL.
此時溶液中溶質為NaOH,根據鈉離子守恒可知n(NaOH)=n(Na+)=0.01mol×2=0.02mol,故溶液中NaOH濃度為=$\frac{0.02mol}{0.25L}$=0.08mol/L,
故答案為:150;NaOH;0.08.
點評 本題考查混合物的有關計算、常用化學計量的有關計算等,難度中等,理解發生反應的本質和元素守恒是解題的關鍵.


科目:高中化學 來源: 題型:填空題
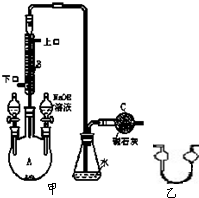 制備溴苯的實驗裝置如圖所示,回答下列問題:
制備溴苯的實驗裝置如圖所示,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是元素周期表中各主族(A)及零族的部分元素符號代碼(陰影處為族序數)
如圖是元素周期表中各主族(A)及零族的部分元素符號代碼(陰影處為族序數)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .CaC2晶胞結構與氯化鈉晶體相似,則在晶體中與鈣離子距離最近的C22-數目為6,這些C22-在空間所圍成的幾何圖形為正八面體
.CaC2晶胞結構與氯化鈉晶體相似,則在晶體中與鈣離子距離最近的C22-數目為6,這些C22-在空間所圍成的幾何圖形為正八面體查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ①②③⑤⑥⑦ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
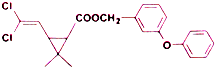
| A. | 分子式為C21H20O3Cl2 | |
| B. | 醚鍵上的氧原子至少與另外11個原子共面 | |
| C. | 分子中不存在手性碳原子 | |
| D. | 在一定條件下可發生加成、取代、氧化反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com