
【題目】某課外活動小組欲利用CuO與NH3的反應研究NH3的性質與分子組成,設計了如下實驗裝置(夾持裝置未畫出)進行實驗。請回答下列問題:
(1)儀器a的名稱為 ;儀器b中的試劑不能為下列中的 (填字母)
A.氧化鈣 B.堿石灰 C.石灰石 D.生石灰

(2)裝置B的作用是
(3)實驗中觀察到裝置C中黑色CuO粉末變為紅色固體,量氣管收集到無色無味的氣體,上述現象證明了NH3具有 性,寫出裝置C中發生反應的化學方程式
(4)E裝置中濃硫酸的作用 (寫出一條即可)
(5)實驗完畢,若測得干燥管D增重mg,裝置F測得氣體的體積為nL(已折算成標準狀況),則氨分子中氮、氫的原子個數比為 (用含m、n字母的代數式表示)
【答案】(1)分液漏斗,C;(2)干燥氨氣;
(3)還原,3CuO+2NH3![]() 3Cu+N2↑+3H2O;
3Cu+N2↑+3H2O;
(4)阻止F中水蒸氣進入D(或吸收未反應的氨氣);(5)9n/11.2m。
【解析】
試題分析:(1)儀器a的名稱為分液漏斗,裝置A作用制取NH3,利用NH3·H2O不穩定,受熱易分解,氧化鈣、堿石灰、生石灰遇水放出大量的熱,使NH3·H2O分解,因此選項C正確;(2)裝置B的作用是干燥NH3,防止水蒸氣對后面實驗產生干擾;(3)CuO變為紅色銅,銅的化合價降低,且量氣管中收集到無色無味的氣體,此氣體為N2,因此NH3表現還原性,反應方程式為:3CuO + 2NH3![]() 3Cu + N2↑ + 3H2O;(4)裝置D的作用是吸收反應中產生的水,同時部分NH3未參加反應,必須吸收,因此裝置E的作用是吸收未反應的氨氣和防止F中的水蒸氣進入D裝置;(5)裝置D增重的是水的質量,則m(H)=m×2/18g,F中測量的氮氣的體積,即n(N)=n×2/22.4mol,則N和H的原子個數比為:n×2/22.4:m×2/18=9n/11.2m。
3Cu + N2↑ + 3H2O;(4)裝置D的作用是吸收反應中產生的水,同時部分NH3未參加反應,必須吸收,因此裝置E的作用是吸收未反應的氨氣和防止F中的水蒸氣進入D裝置;(5)裝置D增重的是水的質量,則m(H)=m×2/18g,F中測量的氮氣的體積,即n(N)=n×2/22.4mol,則N和H的原子個數比為:n×2/22.4:m×2/18=9n/11.2m。


科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。下列說法正確的是
A.一定條件下,0.2 mol SO2與足量O2充分反應,生成SO3分子數為0.2NA
B.0. 1 mol NH2— 中含有的電子數為0.9NA
C.3.4 g H2O2中含有的共用電子對數為0.1NA
D.常溫常壓下,16 g O2和O3混合氣體含有的氧原子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,選擇適當的試劑和方法從中提純出NaCl晶體。相應的實驗過程如下:
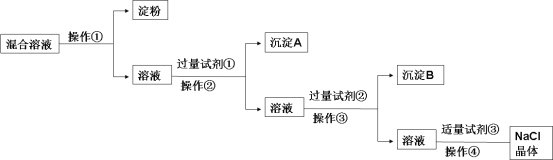
(1)操作①是利用膠體不能通過 而把淀粉膠體和溶液進行分離。
(2)寫出上述實驗過程中所用試劑的化學式:
試劑①___________________;試劑③_____________________。
(3)判斷試劑①已過量的操作是:__________________。
(4)控制試劑③適量的方法是:__________________。
(5)試劑②的作用(用化學方程式表示):__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于乙醇的說法中,不正確的是
A.乙醇是無色透明、有特殊香味的液體 B.乙醇可以使酸性高錳酸鉀溶液褪色
C.乙醇屬于烴類物質 D.無水硫酸銅常用于檢驗乙醇中是否含有水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學變化屬于加成反應的是
A.乙醇在銅作催化劑的條件下加熱和空氣的反應
B.乙烯通入溴的四氯化碳溶液中的反應
C.甲烷在光照條件下與氯氣發生的反應
D.苯與液溴在鐵粉作催化劑的條件下發生的反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
①鋁和銅具有良好的導電性,所以電工操作時,可以把銅線和鋁線擰在一起
②汽車尾氣中含有能污染空氣的氮氧化物,主要是汽油燃燒不充分造成的
③從海水中提取物質都必須通過化學反應才能實現
④“遼寧艦”上用于艦載機降落攔阻索的特種鋼纜屬于新型無機非金屬材料
⑤明礬可以用于凈水,主要是由于Al3+水解生成的少量氫氧化鋁膠體有凈水作用
A.②③⑤ B.①②④ C.①③④⑤ D.①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗及顯色結果的敘述,錯誤的是
A.水浴加熱條件下,麥芽糖與斐林試劑發生反應生成磚紅色沉淀
B.蛋白質溶液遇雙縮脲試劑變紫色
C.人的口腔上皮細胞經健那綠染色后,可以看到呈藍綠色的線粒體
D.常溫條件下,脫氧核糖核酸與吡羅紅作用呈紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究亞硫酸鈉的熱穩定性,某研究性學習小組將無水亞硫酸鈉隔絕空氣加熱,并利用受熱后的固體試樣和下圖所示的實驗裝置進行實驗。請回答下列有關問題:
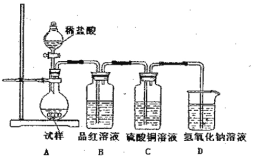
(1)查閱資料:無水亞硫酸鈉隔絕空氣受熱到600℃才開能分解,且分解產物只有硫化鈉和另種固體。如果加熱溫度低于字600℃,向所得冷卻后固體試樣中緩緩滴加稀鹽酸至足量,在滴加稀鹽酸的整個過程中HSO3-的物質的量濃度變化趨勢為 ;
(2)如果加熱溫度為700℃,向所得冷卻后固體試樣中緩緩滴加稀鹽酸至足量,觀察到燒瓶中出現淡黃色沉淀,且有大量氣泡產生,則反應生生成黃色沉淀的離子方程式為 ;此時在B、C兩裝置中可能觀察到的現象為 。
(3)在(2)中滴加定暈鹽酸后,燒瓶內除Cl-外還存在另一種濃度較大的陰離子(X)。為檢驗該陰離子(X),先取固體試樣溶于水配成溶液,然后按以下兩種實驗方案檢驗陰離子(X),認為合理的方案是 (填“甲”或“乙”),請說明另一種方案不合理的原因 。
方案甲:取少量試樣溶液于試管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,證明該離子存在。
方案乙:取少量試樣溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色淀淀生成,證明該離子存在。
(4)寫出Na2SO3固體加熱到600℃以上分解的化學方程式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com