
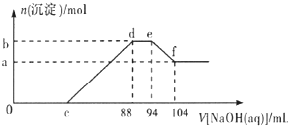
 實驗研究發現,硝酸發生氧化還原反應時,硝酸的濃度越稀,對應還原產物中氮元素的 化合價越低.現有一定量的鋁粉和鐵粉的混合物與一定量很稀的硝酸充分反應,反應過程中無氣體放出.在反應結束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的體積(mL )與產生沉淀的物質的量( mol)關系如圖所示,下列說法不正確的是( )
實驗研究發現,硝酸發生氧化還原反應時,硝酸的濃度越稀,對應還原產物中氮元素的 化合價越低.現有一定量的鋁粉和鐵粉的混合物與一定量很稀的硝酸充分反應,反應過程中無氣體放出.在反應結束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的體積(mL )與產生沉淀的物質的量( mol)關系如圖所示,下列說法不正確的是( )| A、稀硝酸與鋁粉、鐵粉反應,其還原產物為硝酸銨 | B、c點對應NaOH溶液的體積為48 mL | C、b點與a點的差值為0.05 mol | D、樣品中鋁粉和鐵粉的物質的量之比為5:3 |
| 0.2mol |
| 5mol/L |


科目:高中化學 來源: 題型:
(12分)鋼鐵表面發藍(或發黑,在鋼鐵表面形成一層致密的氧化物Fe3O4)可提高其耐磨、耐蝕性能。其原理是:
①在NaOH溶液中,將鐵粉溶解在NaNO2溶液中,除水之外,還可產生A和C。其中C為氣體,能使濕潤的紅色石蕊試紙變藍。
②A能在過量的NaNO2溶液中繼續反應,生成B和C。
③A和B的溶液能繼續反應,生成Fe3O4。
經研究發現:A和B的焰色反應均為黃色,其導電性實驗均為K2SO4型。生成物中A與C、B與C的物質的量之比均為31。回答下列問題:
4-1 寫出并配平化學反應方程式。
4-2 實踐中發現適當提高溫度或增大NaNO2溶液的濃度有利于氧化膜增厚,但加大NaOH溶液濃度對膜層厚度影響不大。試說明原因。
4-3 發藍層遇光氣(COCl2),若不及時清洗,則發藍層的完整性將被破壞。寫出有關的化學反應方程式。
4-4 有一種隱形材料D可由B與Zn(NO3)2 反應生成,也可用以硝酸鐵、硝酸鋅、氫氧化鈉等為原料的水熱合成法。請確定D的化學式,并判斷上述制備D的反應是否屬于氧化還原反應。此法所得產品D能夠隱形的原因是什么?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com