
 SiCl4在室溫下為無色液體,易揮發(fā),有強烈的刺激性.把SiCl4先轉化為SiHCl3,再經氫氣還原生成高純硅.
SiCl4在室溫下為無色液體,易揮發(fā),有強烈的刺激性.把SiCl4先轉化為SiHCl3,再經氫氣還原生成高純硅.分析 (1)高溫條件下,SiHCl3與氫氣反應生成Si與HCl;
(2)根據蓋斯定律,由已知熱化學方程式乘以合適的系數進行加減構造目標熱化學方程式,反應熱也進行相應的計算;
(3)由圖可知,四氯化碳的轉化率在500℃達最高;開始反應未到達平衡,溫度升高反應速率加快,轉化率增大;
(4)①根據v=$\frac{△c}{△t}$計算v(SiHCl3),再利用速率之比等于其化學計量數之比計算v(SiCl4);
②化學平衡常數,是指在一定溫度下,可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,固體、純液體不需要寫出;
升高溫度,平衡向吸熱反應方向移動,據此判斷平衡常數變化;
③利用濃度變化量之比等于其化學計算之比計算H2的濃度變化量,進而計算氫氣的起始濃度,再根據n=cV計算氫氣的物質的量,根據V=nVm計算標況下氫氣的體積;
④若平衡后再向容器中充人與起始時等量的SiCl4和H2(假設Si足量),等效為壓強增大一倍,平衡向正反應方向移動;
⑤平衡后,將容器的體積壓縮為1L,壓強增大,平衡向正反應方向移動,若平衡不移動,此時氫氣濃度為極大值,平衡移動不能消除氫氣濃度增大,到達新平衡時的濃度仍大于原平衡時的濃度.
解答 解:(1)高溫條件下,SiHCl3與氫氣反應生成Si與HCl,反應方程式為:SiHCl3+H2$\frac{\underline{\;高溫\;}}{\;}$Si+3HCl,
故答案為:SiHCl3+H2$\frac{\underline{\;高溫\;}}{\;}$Si+3HCl;
(2)已知:(i)Si(s)+4HCl(g)=SiCl4(g)+2H2(g)△H=-241kJ.mol-1
(ii)Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ.mol-1
則SiCl4轉化為SiCl3的反應(iii):
(ii)×4-(i)×3可得:3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g),故△H=4×(-210kJ.mol-1
)-3×(-241kJ.mol-1)=-117kJ.mol-1,
故答案為:-117kJ.mol-1;
(3)由圖可知,四氯化碳的轉化率在500℃達最高,故最適宜的溫度為500℃;開始反應未到達平衡,溫度升高反應速率加快,四氯化碳的轉化率增大,
故答案為:500℃;開始反應未到達平衡,溫度升高反應速率加快,四氯化碳的轉化率增大;
(4)①6h后達到平衡,SiHCl3的物質量濃度為0.2mol.L-1,則v(SiHCl3)=$\frac{0.2mol/L}{6h}$=$\frac{1}{30}$mol/(L.h),速率之比等于其化學計量數之比,則v(SiCl4)=$\frac{3}{4}$v(SiHCl3)=$\frac{3}{4}$×$\frac{1}{30}$mol/(L.h)=0.025mol/(L.h),
故答案為:0.025mol/(L.h);
②3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)的平衡常數表達式K=$\frac{{c}^{4}(SiHC{l}_{3})}{{c}^{3}(SiC{l}_{4})×{c}^{2}({H}_{2})}$,該反應正反應為放熱反應,升高溫度,平衡向逆反應方向移動,平衡常數減小,
故答案為:$\frac{{c}^{4}(SiHC{l}_{3})}{{c}^{3}(SiC{l}_{4})×{c}^{2}({H}_{2})}$;減小;
③濃度變化量之比等于其化學計算之比,則H2的濃度變化量為0.2mol.L-1×$\frac{1}{2}$=0.1mol.L-1,故氫氣的起始濃度為1mol.L-1+0.1mol.L-1=1.1mol.L-1,則通入氫氣的物質的量為2L×1.1mol.L-1=2.2mol,標況下氫氣的體積為2.2mol×22.4L/mol=49.28L,
故答案為:49.28L;
④若平衡后再向容器中充人與起始時等量的SiCl4和H2(假設Si足量),等效為壓強增大一倍,平衡向正反應方向移動,有方程式可知1mol氫氣反應時,混合氣體總物質的量減小1mol,故到達新平衡時氫氣的體積分數減小,
故答案為:減小;
⑤平衡后,將容器的體積壓縮為1L,壓強增大,平衡向正反應方向移動,若平衡不移動,此時氫氣濃度為極大值為2×1mol.L-1=2mol.L-1,平衡移動不能消除氫氣濃度增大,到達新平衡時的濃度仍大于原平衡時的濃度1mol.L-1,故再次達到平衡時,H2的物質的量濃度范圍為:1mol.L-1<c(H2)<2mol.L-1,
故答案為:1mol.L-1<c(H2)<2mol.L-1.
點評 本題考查方程式書寫、反應熱計算、化學反應速率計算、平衡常數及影響因素、化學平衡計算及移動等,(4)中⑤注意利用極限法與平衡移動原理方向解答,題目難度中等.


 ABC考王全優(yōu)卷系列答案
ABC考王全優(yōu)卷系列答案科目:高中化學 來源: 題型:選擇題
| 弱酸 | H2CO3 | 水楊酸(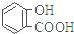 ) ) |
| 電離平衡常數(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常溫下,等濃度、等體積的NaHCO3 溶液pH小于 溶液pH 溶液pH | |
| B. | 常溫下,等濃度、等體積的Na2 CO3 溶液和 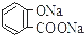 溶液中所含離子總數前者小于后者 溶液中所含離子總數前者小于后者 | |
| C. | 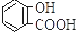 +2NaHCO3→ +2NaHCO3→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水楊酸的第二級電離 Ka2 遠小于第一級電離Ka1 的原因之一是 能形成分子內氫鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉、纖維素和油脂都是天然高分子化合物 | |
| B. | 乙酸乙酯在堿性條件下的水解反應稱為皂化反應 | |
| C. | 乙醇能使酸性高錳酸鉀溶液褪色,發(fā)生的是氧化反應 | |
| D. | 乙烯可以與氫氣發(fā)生加成反應,苯不能與氫氣加成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉和纖維素互為同分異構體 | |
| B. | 糖類、油脂和蛋白質是基本營養(yǎng)物質,它們都是天然高分子化合物 | |
| C. | 可以用溴水鑒別苯、CCl4和無水乙醇 | |
| D. | 苯可以發(fā)生取代反應和加成反應,但是無法發(fā)生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
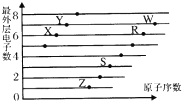 如圖是部分短周期元素原子(用字母表示)最外層電子數與原子序數的關系圖.下列說法正確的是( )
如圖是部分短周期元素原子(用字母表示)最外層電子數與原子序數的關系圖.下列說法正確的是( )| A. | 該圖體現出原子核外電子層呈現周期性變化 | |
| B. | 簡單離子半徑:W->R2->Z+>S3+ | |
| C. | R、Z形成的化合物中可能含有共價鍵 | |
| D. | 由酸性:HWO4>H2RO3可證明非金屬性:W>R |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 L 0.1 mol/L Na2CO3溶液中,陰離子總數大于0.1 NA | |
| B. | 常溫常壓下,1 mol甘氨酸中含C-H鍵數目為3 NA | |
| C. | 標準狀況下,6.72 L NO2與水充分反應轉移的電子數目為0.1 NA | |
| D. | 50℃時,10 L pH=13的NaOH溶液中含有的OH-數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ”,當
”,當查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 因為H-F的鍵能大于H-CI,所以HF的沸點高于HCI | |
| B. | 因為HCIO4比HCIO中的氯元素的化合價高,所以HCIO4的氧化性強于HCIO | |
| C. | 因為N元素的非金屬性比P元素強,所以NH3的穩(wěn)定性強于PH3 | |
| D. | 因為Fe的還原性強于Cu,所以Cu2+的氧化性強于Fe3+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com