
【題目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某溫度下,向2L的密閉容器中通入N2O5,部分實驗數據見下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某溫度下,向2L的密閉容器中通入N2O5,部分實驗數據見下表:
時間/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列說法正確的是( )
A.在1000s內,反應吸收的熱量為2.5Q kJ
B.在500s內,O2分解速率為3×10-3 mol·L-1·s-1
C.在1000s時,反應恰好達到平衡
D.在1500s時,N2O5的正反應速率等于NO2的逆反應速率
【答案】A
【解析】
A.由表中數據可知,在1000s內,消耗n(N2O5)為5.0mol,根據反應方程式可知,每消耗2molN2O5,反應吸收的熱量為QkJ,則消耗5.0mol N2O5,反應吸收的熱量為2.5QkJ,A項正確;
B.根據表中數據,500s時,n(N2O5)為7.0mol,N2O5的反應速率=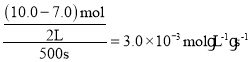 ,根據同一反應各物質的速率之比等于化學反應方程式各物質的計量數之比,可知用O2表示的反應速率=
,根據同一反應各物質的速率之比等于化學反應方程式各物質的計量數之比,可知用O2表示的反應速率=![]() ,B項錯誤;
,B項錯誤;
C.對比1000s和1500s時n(N2O5)的值,可知反應達平衡狀態,但在1000s時反應不一定恰好達到平衡狀態。C項錯誤;
D.對比1000s和1500s時n(N2O5)的值,可知1500s時反應達平衡狀態,根據同一反應各物質的速率之比等于化學反應方程式各物質的計量數之比,可知v正(N2O5)=2v正(NO2),反應達平衡時,v正(NO2)=v逆(NO2),則v正(N2O5)=2v逆(NO2),D項錯誤;
答案選A。


 互動英語系列答案
互動英語系列答案 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案 黃岡海淀全程培優測試卷系列答案
黃岡海淀全程培優測試卷系列答案科目:高中化學 來源: 題型:
【題目】下表各組物質之間通過一步反應不可以實現如圖所示轉化關系的是( )
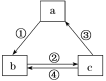
選項 | a | b | c | 箭頭上所標數字的反應條件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入過量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常溫加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯氣 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:A是石油裂解氣的主要成分,A的產量通常用來衡量一個國家的石油化工水平。現以A為主要原料合成乙酸乙酯,其合成路線如下,回答下列問題:
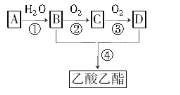
⑴寫出A、C的名稱________、_________。
⑵B、D分子中的官能團化學式分別是__________、__________。
⑶寫出下列反應的反應類型:
①______________,④____________。
⑷寫出下列反應的化學方程式:
①__________________;
②__________________;
③___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列圖示所得出的結論正確的是
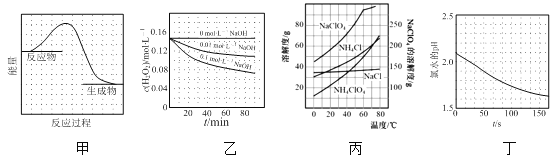
A.圖甲表示某反應過程中的能量變化曲線,可推知該反應是吸熱反應
B.圖乙表示70℃時不同堿性條件下H2O2的濃度隨時間變化的曲線,可推知溶液堿性越強,H2O2分解速率越慢
C.圖丙表示部分物質的溶解度隨溫度變化的曲線,可推知20℃時向含a mol NaClO4的飽和溶液中加入a mol NH4Cl固體會有NH4ClO4固體析出
D.圖丁表示光照下氯水的pH隨時間的變化曲線,可推知光照后溶液中Cl2濃度增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應在含氯物質的制取、含量測定等方面有重要的作用。
⑴將一定量的氯氣通入過量NaOH溶液中,由于副反應的存在,溶液中同時存在Cl-、ClO-和ClO3-。若Cl-、ClO-和ClO3-的物質的量分別為a mol、b mol和c mol,根據電子得失守恒可知a、b、c之間一定存在的等量關系是______。
⑵工業次氯酸鈉溶液中含有氯酸鈉會影響產品質量。測定次氯酸鈉樣品中的氯酸鈉含量的過程如下:
步驟Ⅰ:取10.00 mL 堿性NaClO溶液試樣,加入過量H2O2,將ClO-完全還原成Cl-(ClO3-在該條件不與H2O2反應),加熱煮沸,冷卻至室溫,加入硫酸至酸性,
步驟Ⅱ:向步驟Ⅰ所得溶液中加入0.1000 mol·L-1硫酸亞鐵溶液30.00 mL,充分反應后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至終點,消耗該溶液20.00 mL。
已知步驟Ⅱ中涉及的相關反應轉化為:ClO3-![]() Cl-,Cr2O72-
Cl-,Cr2O72-![]() Cr3+,則堿性NaClO溶液試樣中所含NaClO3的物質的量濃度為______mol·L-1。
Cr3+,則堿性NaClO溶液試樣中所含NaClO3的物質的量濃度為______mol·L-1。
⑶NaClO2廣泛用于造紙工業、污水處理等,可由ClO2為原料反應制得。某溶液X中同時含有ClO2和NaClO2,為測定其中ClO2-的濃度,現進行如下實驗:
步驟1:量取25.00 mL溶液X,調節溶液的pH為8.0,加入足量的KI晶體(發生反應:2ClO2+2I-=2ClO2-+I2)。滴入2滴淀粉溶液,滴加0.02000 mol·L-1Na2S2O3溶液(發生反應:2Na2S2O3+I2=Na2S4O6+2NaI)。恰好完全反應時,消耗Na2S2O3溶液12.50 mL。
步驟2:調節上述反應后溶液的pH為1.0(發生反應:ClO2-+4H++4I-=Cl-+2I2+2H2O),滴加0.2500 mol·L-1Na2S2O3溶液。恰好完全反應時,消耗Na2S2O3溶液40.00 mL。請計算溶液X中ClO2-的物質的量濃度(寫出計算過程)。_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據碘與氫氣反應的熱化學方程式
(i) I2(g)+ H2(g)![]() 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g)![]() 2HI(g);△H=+26.48 kJ·mol-1下列判斷正確的是
2HI(g);△H=+26.48 kJ·mol-1下列判斷正確的是
A.254g I2(g)中通入2gH2(g),反應放熱9.48 kJ
B.反應(i)的產物比反應(ii)的產物穩定
C.1 mol固態碘與1 mol氣態碘所含的能量相差17.00 kJ
D.反應(ii)的反應物總能量比反應(i)的反應物總能量低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】被稱之為“軟電池”的紙質電池,其電池總反應為Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列說法正確的是( )
ZnO+2MnO(OH)。下列說法正確的是( )
A.該電池的正極為鋅
B.該電池反應中二氧化錳起催化劑作用
C.當65 g Zn完全溶解時,流經電極的電子為1mol
D.電池正極反應式為2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知熱化學方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反應,最終放出的熱量為( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反應,最終放出的熱量為( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.水的電離平衡線如圖所示.若以A點表示25℃時水在電離平衡時的離子濃度,當溫度上升到100℃時,水的電離平衡狀態到B點

(1)在100℃時,Kw表達式為_______,在此溫度下,kw為___.
(2)在室溫下,將pH=9的Ba(OH)2溶液與pH=5的稀鹽酸混合,欲使混合溶液pH=7則Ba(OH)2與鹽酸的體積比為____.
(3)室溫時將PH為3的硫酸溶液稀釋100倍,稀釋后溶液中,C(SO42-)和C(H+)之比約為___.
II.今有①CH3COOH ②HCl ③H2SO4三種溶液.根據要求回答下列問題:
(1)寫出①的電離方程式_______.
(2)當它們pH相同時,其物質的量濃度最大的是___(填序號).
(3)當它們的物質的量濃度相同時,其pH最小是___(填序號).
(4)在室溫下,將c(H+)均為0.01mol/L的三種酸分別加水稀釋至原來的10倍,c(H+)由大到小的順序為___(填序號).
(5)體積和物質的量濃度均相同的①②③三種酸溶液,分別與相同濃度的燒堿溶液恰好完全反應,所需燒堿的體積比為____.
(6)三酸的pH相同時,若耗等量的Zn,則需三酸的體積大小關系為___(填序號).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com