
下列圖示與對應的敘述相符的是

A.圖甲中曲線表示向等體積、等物質的量濃度的鹽酸和醋酸溶液中,分別加入足量鎂粉,產生H2的物質的量的變化
B.圖乙表示將0.10 mol/LNaOH溶液分別滴加到濃度相同的三種一元酸中,由圖可知③的酸性最強
C.圖丙為水的電離平衡曲線,若從A點到C點,可采用在水中加入適量NaOH固體的方法
D.圖丁中曲線表示將pH相同的NH4Cl溶液和稀鹽酸稀釋相同倍數時,二者pH的變化向容積均為0.5L的
B
【解析】
試題分析:A.HCl、CH3COOH都是一元酸,二者的濃度相等,體積相等,即物質的量相等。但由于HCl是強酸,C(H+)=C(HCl),CH3COOH是弱酸,C(H+)<C(CH3COOH).故向等體積、等物質的量濃度的鹽酸和醋酸溶液中,分別加入足量鎂粉,產生氫氣的速率HCl快,最后得到的氫氣的物質的量相等。錯誤。B.溶液中的C(H+)的濃度越大,PH就越小,溶液的酸性就越強。所以根據圖示可知③的酸性最強。正確。C.A點為室溫下的水的電離平衡曲線,B點為100度下的水的電離平衡曲線。C點介于二者之間,說明其溫度100>t>20. 從A點到C點,可采用的方法是升高溫度。錯誤。D. NH4Cl為強酸弱堿鹽,水解顯酸性,HCl是強酸,電離產生H+使溶液顯酸性。若將pH相同的NH4Cl溶液和稀鹽酸稀釋相同倍數時,由于HCl只存在酸的電離,所以H+的濃度變化較大,pH的變化大,而對NH4Cl來說,稀釋使水解平衡正向移動,因此水解產生的H+的濃度在稀釋的基礎上又有所補充,故PH變化較小。錯誤。
考點:考查圖像法在溶液稀釋、化學反應中的應用的知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
A、圖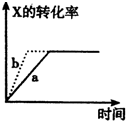 所示,反應:X(g)+2Y(g)?3Z(g),b的壓強一定比a大 所示,反應:X(g)+2Y(g)?3Z(g),b的壓強一定比a大 | B、圖 表明合成氨反應是放熱反應,b表示在反應體系中加入了催化劑 表明合成氨反應是放熱反應,b表示在反應體系中加入了催化劑 | C、圖 所示,t1℃時質量分數均為20%的甲乙兩種溶液,升溫到t2℃時,兩種溶液中溶質的質量分數仍然相等 所示,t1℃時質量分數均為20%的甲乙兩種溶液,升溫到t2℃時,兩種溶液中溶質的質量分數仍然相等 | D、圖 所示,用水稀釋PH相同的鹽酸和醋酸,Ⅰ表示醋酸,Ⅱ表示鹽酸,且溶液導電性:c>b>a 所示,用水稀釋PH相同的鹽酸和醋酸,Ⅰ表示醋酸,Ⅱ表示鹽酸,且溶液導電性:c>b>a |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com