
分析 I.(1)0.1mol•L-1的鹽酸、硫酸、醋酸三種溶液,a=0.1mol/L,b=0.2mol/L,c<0.1mol/L;
(2)均發生酸堿中和反應,等體積等濃度時酸的物質的量相同,由酸根離子守恒可知生成鹽的物質的量相同;
(3)中和一定量NaOH溶液生成正鹽時,硫酸中氫的物質的量為鹽酸、醋酸的2倍;
II.(1)Na2CO3為強堿弱酸鹽,CO3 2-水解:CO32-+H2O?HCO3-+OH-,使溶液呈堿性;
(2)酸性越弱,對應鹽的水解程度越大,溶液的堿性越強.
解答 解:I.鹽酸、硫酸為強酸,醋酸為弱酸,且鹽酸和醋酸為一元酸,硫酸為二元酸,
(1)0.1mol•L-1的鹽酸、硫酸、醋酸三種溶液,a=0.1mol/L,b=0.2mol/L,c<0.1mol/L,則b>a>c,
故答案為:b>a>c;
(2)均發生酸堿中和反應,等體積等濃度時酸的物質的量相同,由酸根離子守恒可知生成鹽的物質的量相同,即鹽的物質的量為n1=n2=n3,
故答案為:n1=n2=n3;
(3)中和一定量NaOH溶液生成正鹽時,設NaOH的物質的量為0.1mol,醋酸和鹽酸消耗NaOH相同均為1L,硫酸中氫離子濃度最大,消耗的酸體積就最少,硫酸體積為0.5L,可知需上述三種酸的體積V1L、V2L、V3L的大小關系為V1=2V2=V3,
故答案為:V1=2V2=V3.
II.(1)Na2CO3為強堿弱酸鹽,CO3 2-離子水解:CO32-+H2O?HCO3-+OH-,使溶液呈堿性,將該溶液加熱蒸干灼燒可得到碳酸鈉固體;
故答案為:堿;Na2CO3;
(2)已知在相同的條件下,醋酸的酸性強于碳酸的酸性,濃度為0.1mol•L-1CH3COONa溶液pH為a,濃度為0.1mol•L-1NaHCO3溶液pH為b,酸性越弱,對應鹽的水解程度越大,溶液的堿性越強,所以NaHCO3溶液的堿性強,pH大,即a<b;
故答案為:<.
點評 本題考查較綜合,涉及酸的電離、鹽的水解、酸堿混合的計算等,把握氫離子的物質的量比較、鹽是水解影響因素及中和反應的實質為解答的關鍵,側重分析與應用能力的考查,題目難度中等.


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:解答題
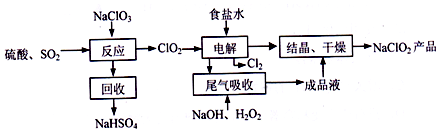
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | TI3+>Fe3+>Ag+ | B. | Fe3+>Ag+>TI3+ | C. | Tl+>Ag+>Fe2+ | D. | TI3+>Ag+>Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
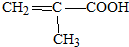 .
.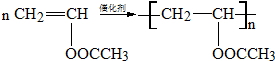 .
.
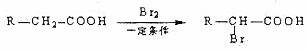 D可以發生如下轉化關
D可以發生如下轉化關 系:
系: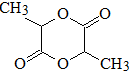 .并寫出N發生消去反應的化學方程式CH3CH(OH)COOH$→_{△}^{濃硫酸}$CH2=CHCOOH+H2O.
.并寫出N發生消去反應的化學方程式CH3CH(OH)COOH$→_{△}^{濃硫酸}$CH2=CHCOOH+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,正反應速率減慢,逆反應速率加快,化學平衡向逆反應方向移動 | |
| B. | 增大壓強,正反應與逆反應速率均增大,平衡不移動 | |
| C. | 增大A2(g)的濃度,化學平衡向正反應方向移動,A2的轉化率增大 | |
| D. | 增大B的物質的量,化學平衡向正反應方向移動,A2的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氯化亞銅(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于濃鹽酸會生成HCuC12,常用作催化劑.實驗室可用廢銅屑、濃鹽酸、食鹽及氧氣制取CuCl.已知KMnO4不與稀鹽酸反應,回答下列問題:
氯化亞銅(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于濃鹽酸會生成HCuC12,常用作催化劑.實驗室可用廢銅屑、濃鹽酸、食鹽及氧氣制取CuCl.已知KMnO4不與稀鹽酸反應,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
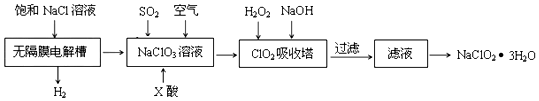
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com