
| 相對原子質量 | 密度/(g.cm-3) | 沸點/℃ | 水中溶解性 | |
| 異戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸異戊醇 | 130 | 0.8670 | 142 | 難溶 |
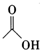 +
+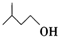 $?_{△}^{濃H_{2}SO_{4}}$
$?_{△}^{濃H_{2}SO_{4}}$ 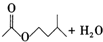
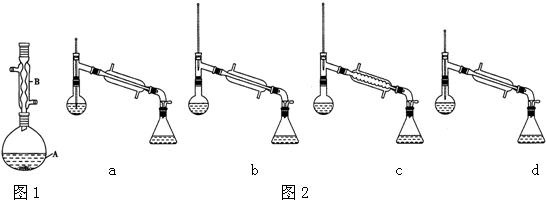
分析 在裝置A中加入反應混合物和2~3片碎瓷片,開始緩慢加熱A,利用冷凝管冷凝回流50分鐘,反應液冷至室溫后,倒入分液漏斗中,先用少量水洗掉大部分硫酸和醋酸,再用水洗滌碳酸氫鈉溶液,分出的產物加入少量無水硫酸鎂固體作干燥劑,靜置片刻,過濾除去硫酸鎂固體,進行蒸餾純化,收集140~143℃餾分,得乙酸異戊酯,還考查了反應物轉化率的提高方法,同時進行產率的計算有誤差分析.
(1)根據題中儀器B的構造判斷該儀器的名稱;
(2)在洗滌操作中,第一次洗滌的主要目的是除去大部分催化劑硫酸和醋酸;第二次水洗,主要目的是除去產品中殘留的碳酸氫鈉;
(3)根據乙酸異戊酯的密度及正確的分液操作方法進行解答;
(4)根據反應物對增加一種反應物的濃度,可以使另一種反應物的轉化率提高進行判斷加入過量乙酸的目的;
(5)少量無水硫酸鎂能夠吸收乙酸異戊酯中少量的水分,起到干燥作用;
(6)先根據溫度計在蒸餾操作中的作用排除ad,再根據球形冷凝管容易使產品滯留,不能全部收集到錐形瓶中,得出正確結論;
(7)先計算出乙酸和異戊醇的物質的量,然后判斷過量情況,根據不足量計算出理論上生成乙酸異戊酯的物質的量,最后根據實際上制取的乙酸異戊酯計算出產率;
(8)若從130℃便開始收集餾分此時的蒸氣中含有異戊醇,會收集少量的未反應的異戊醇,導致獲得的乙酸異戊酯質量偏大.
解答 解:(1)由裝置中儀器B的構造可知,儀器B的名稱為球形冷凝管,
故答案為:球形冷凝管;
(2)反應后的溶液要經過多次洗滌,在洗滌操作中,第一次洗滌的主要目的是除去大部分催化劑硫酸和醋酸;第一步中飽和碳酸氫鈉溶液既可以除去未洗凈的醋酸,也可以降低酯的溶解度,但第一步洗滌后生成的酯中混有碳酸氫鈉,所以第二次水洗,主要目的是除去產品中殘留的碳酸氫鈉,
故答案為:洗掉大部分硫酸和醋酸;洗掉碳酸氫鈉;
(3)由于酯的密度比水小,二者互不相溶,因此水在下層,酯在上層;分液時,要先將水層從分液漏斗的下口放出,待到兩層液體界面時關閉分液漏斗的活塞,再將乙酸異戊酯從上口放出,所以正確的為D,
故答案為:D;
(4)酯化反應是可逆反應,增大反應物的濃度可以使平衡正向移動;增加一種反應物的濃度,可以使另一種反應物的轉化率提高,因此本實驗中加入過量乙酸的目的是提高轉化率,
故答案為:提高醇的轉化率;
(5)實驗中加入少量無水硫酸鎂的目的是吸收酯中少量的水分,對乙酸異戊酯進行干燥,
故答案為:干燥;
(6)在蒸餾操作中,溫度計的水銀球要放在蒸餾燒瓶的支管口處,所以ad錯誤;c中使用的是球形冷凝管容易使產品滯留,不能全部收集到錐形瓶中,因此儀器及裝置安裝正確的是b,
故答案為:b;
(7)乙酸的物質的量為:n=$\frac{6.0g}{60g/mol}$=0.1mol,異戊醇的物質的量為:n=$\frac{4.4g}{88g/mol}$=0.05mol,由于乙酸和異戊醇是按照1:1進行反應,所以乙酸過量,生成乙酸異戊酯的量要按照異戊醇的物質的量計算,即理論上生成0.05mol乙酸異戊酯;實際上生成的乙酸異戊酯的物質的量為=$\frac{3.9g}{130g/mol}$=0.03mol,所以實驗中乙酸異戊酯的產率為:$\frac{0.03}{0.05}$×100%=60%,
故答案為:D;
(8)在進行蒸餾操作時,若從130℃便開始收集餾分此時的蒸氣中含有異戊醇,會收集少量的未反應的異戊醇,因此會導致產率偏高,
故答案為:高;會收集少量未反應的異戊醇.
點評 本題為一道高考題真題,考查了常見儀器的構造與安裝、混合物的分離、提純、物質的制取、藥品的選擇及使用、物質產率的計算等知識,題目難度較大,試題涉及的題量較大,知識點較多,充分培養了學生的分析、理解能力及靈活應用所學知識的能力.


 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2 $\frac{\underline{\;點燃\;}}{\;}$2MgO | ||
| C. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | D. | Cu(OH)2 $\frac{\underline{\;△\;}}{\;}$CuO+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2LSO2和2LCO2 | B. | 9 g水和標準狀況下 11.2LCO2 | ||
| C. | 標準狀況下1mol氧氣和 22.4L水 | D. | 0.1mol氫氣和 2.24L氯化氫氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 仍平衡 | B. | 盛鈉的一端下沉 | C. | 盛鎂的一端下沉 | D. | 不能確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
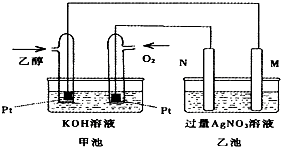
| A. | 若用此裝置給鐵棒上鍍上層銀,則N電極改用鐵電極,M電極改用銀電極 | |
| B. | 甲池中負極的電極反應式為:CH3CH2OH-12e-+3H2O=2CO2+12H+ | |
| C. | 甲池KOH溶液中經過0.05mol電子時,理論上乙池中的M電極質量增加5.04g | |
| D. | M電極上的電極反應式為:Ag++e-=Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O+NaCl | B. | 3CO+Fe2O3$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2KBr═Br2+2KCl | D. | NH3+CO2+H2O═NH4HCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 W、X、Y、Z分別為H、C、N、O元素.
W、X、Y、Z分別為H、C、N、O元素.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com