
【題目】下表是元素周期表的一部分,回答下列有關問題:
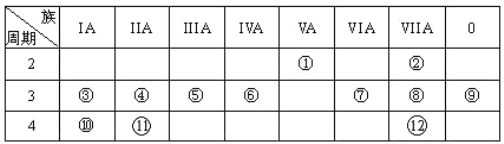
(1)寫出下列元素符號:①__________⑥_________⑦_________
(2)畫出原子的結構示意圖:④_____________⑧____________
(3)在①~元素中,金屬性最強的元素是_________,非金屬性最強的元素是_________,最不活潑的元素是_________(均填元素符號)
(4)元素⑦與元素⑧相比,非金屬性較強的是_________(用元素符號表示),下列表述中能證明這一事實的是_________。
a.常溫下⑦的單質和⑧的單質狀態不同
b.⑧的氫化物比⑦的氫化物穩定
c.一定條件下⑦和⑧的單質都能與氫氧化鈉溶液反應
【答案】 N Si S 
 K F Ar Cl b
K F Ar Cl b
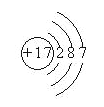
【解析】本題考查元素周期表的結構。(1)①位于元素周期表中第二周期第VA族,①為N元素;⑥位于元素周期表中第三周期第IVA族,⑥為Si元素;⑦位于元素周期表中第三周期第VIA族,⑦為S元素;(2)④位于元素周期表中第三周期第IIA族,④為Mg元素,其原子結構示意圖為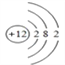 ;⑧位于元素周期表中第三周期第VIIA族,⑧為Cl元素,其原子結構示意圖為
;⑧位于元素周期表中第三周期第VIIA族,⑧為Cl元素,其原子結構示意圖為 ;(3)根據元素周期律,可知金屬性最強的元素是K;非金屬性最強的元素是F;最不活潑的0族元素,即⑨元素是Ar;(4)元素⑦(S)與元素⑧(Cl)相比,非金屬性較強的是Cl;單質狀態不同,不能比較其非金屬性強弱,a項錯誤;簡單氫化物越穩定,說明其非金屬性越強,b項正確;單質都能與氫氧化鈉溶液反應,不能比較非金屬性強弱,c項錯誤。
;(3)根據元素周期律,可知金屬性最強的元素是K;非金屬性最強的元素是F;最不活潑的0族元素,即⑨元素是Ar;(4)元素⑦(S)與元素⑧(Cl)相比,非金屬性較強的是Cl;單質狀態不同,不能比較其非金屬性強弱,a項錯誤;簡單氫化物越穩定,說明其非金屬性越強,b項正確;單質都能與氫氧化鈉溶液反應,不能比較非金屬性強弱,c項錯誤。
金屬性比較 | 本質 | 原子越易失電子,金屬性越強 |
判斷 依據 | ①在金屬活動性順序中位置越靠前,金屬性越強 | |
②單質與水或非氧化性酸反應越劇烈,金屬性越強 | ||
③單質還原性越強或離子氧化性越弱,金屬性越強 | ||
④最高價氧化物對應水化物的堿性越強,金屬性越強 | ||
⑤若Xn++Y―→X+Ym+,則Y金屬性比X強 | ||
非金屬性比較 | 本質 | 原子越易得電子,非金屬性越強 |
判斷 依據 | ①與H2化合越容易,氣態氫化物越穩定,非金屬性越強 | |
②單質氧化性越強,陰離子還原性越弱,非金屬性越強 | ||
③最高價氧化物對應水化物的酸性越強,非金屬性越強 | ||
④An-+B―→Bm-+A,則B非金屬性比A強 |


科目:高中化學 來源: 題型:
【題目】用下列方法均可制得氧氣:
(1)2KClO3==2KCl+3O2↑
(2)2BaO2+2H2O===2Ba(OH)2+O2↑
(3)2HgO==2Hg+O2↑
(4)2KMnO4==K2MnO4+MnO2+O2↑
若要制得相同質量的氧氣,反應中電子轉移數目之比為
A.3∶2∶1∶4 B.1∶1∶1∶1
C.2∶1∶2∶2 D.1∶2∶1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,在盛有水的燒杯中,鐵圈和銀圈的連接處吊著一根絕緣的細絲,使之平衡.小心地從燒杯中央滴入CuSO4溶液. 
(1)片刻后可觀察到的現象是(指懸吊的金屬圈) .
A.鐵圈和銀圈左右搖擺不定
B.保持平衡狀態不變
C.鐵圈向下傾斜
D.銀圈向下傾斜
(2)產生上述現象的原因是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯元素在自然界有35Cl和37Cl兩種同位素,在計算式34.969×75.77%+36.966×24.23% =35.453中,說法不正確的是
A.75.77%表示35Cl的質量分數B.24.23%表示37Cl的豐度
C.35. 453表示氯元素的相對原子質量D.36.966表示37Cl的相對原子質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4mol SO2與2molO2放入4L的密閉容器中,在一定條件下反應達到平衡:2SO2+O22SO3測得平衡時混合物總的物質的量為5mol,求:
(1)平衡時各物質的濃度;
(2)平衡時SO2的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D 原子序數依次增加,X、Y、Z、W是由這四種元素中的兩種元素組成的常見化合物,X為有刺激性氣味的氣體,Y為淡黃色固體,甲是由C元素形成的氣體單質,乙為紅棕色氣體,上述物質之間的轉化關系如下圖所示(部分反應物或生成物省略)。下列說法正確的是

A. 原子半徑大小順序:D>C>B>A B. 最簡單氣態氫化物的穩定性:B>C
C. 圖示轉化關系涉及的反應均為氧化還原反應 D. 元素C、D形成的化合物中一定只含離子鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com