
【題目】恒溫下,將a mol N2與b mol H2的混合氣體通入一個V升固定容積的密閉容器中,發生如下反應:N2 (g)+3H2(g)═2NH3(g)
(1)若反應進行到t分鐘時,nt(N2)=13mol,nt(NH3)=6mol,計算a= , 反應速率V(H2)=molL﹣1min﹣1 .
(2)下列描述中能表明反應已達到平衡狀態的是 ①混合氣體的壓強不變 ②混合氣體的密度不變 ③混合氣體的平均摩爾質量不變
④容器內N2 , H2 , NH3的濃度之比為1:3:2 ⑤單位時間內生成n mol NH3 , 同時生成N2 , H2共2n mol
(3)反應達平衡時,混合氣體的體積為716.8L(標況下),其中NH3的含量(體積分數)為25%.計算平衡時NH3的物質的量n(NH3)=mol,N2和H2的轉化率之比,α(N2):α(H2)= . (寫最簡整數比)
【答案】
(1)16;![]()
(2)③
(3)8;1:2
【解析】解:(1)反應進行到t時,測的N2為13mol,NH3為6mol,由方程式可知,參加反應的氮氣的物質的量為:6mol× ![]() =3mol,故氮氣的起始物質的量為:13mol+3mol=16mol,即a=16; nt(NH3)=6mol,則用氨氣表示的平均反應速率為:v(NH3)=
=3mol,故氮氣的起始物質的量為:13mol+3mol=16mol,即a=16; nt(NH3)=6mol,則用氨氣表示的平均反應速率為:v(NH3)= ![]() =
= ![]() molL﹣1min﹣1 , 根據反應速率與化學計量數成正比可知,v(H2)=
molL﹣1min﹣1 , 根據反應速率與化學計量數成正比可知,v(H2)= ![]() v(NH3)=
v(NH3)= ![]() molL﹣1min﹣1 ,
molL﹣1min﹣1 ,
所以答案是:16; ![]() ;(2)①該反應為氣體體積縮小的反應,反應過程中壓強發生變化,當混合氣體的壓強不變時,表明正逆反應速率相等,達到了平衡狀態,故①錯誤;②反應前后氣體的體積和總質量不變,則混合氣體的密度始終不變,不能根據密度判斷平衡狀態,故②錯誤;③該反應氣體的總質量不變,氣體總物質的量發生變化,則混合氣體的平均摩爾質量發生變化,當平均摩爾質量不變時,表明該反應已經達到平衡狀態,故③正確;④容器內N2 , H2 , NH3的濃度之比為1:3:2,無法判斷各組分的濃度是否變化,則無法判斷是否達到平衡狀態,故④錯誤;⑤單位時間內生成n mol NH3 , 同時生成N2 , H2共2n mol,無法判斷氮氣、氫氣的物質的量,則無法判斷平衡狀態,故⑤錯誤;
;(2)①該反應為氣體體積縮小的反應,反應過程中壓強發生變化,當混合氣體的壓強不變時,表明正逆反應速率相等,達到了平衡狀態,故①錯誤;②反應前后氣體的體積和總質量不變,則混合氣體的密度始終不變,不能根據密度判斷平衡狀態,故②錯誤;③該反應氣體的總質量不變,氣體總物質的量發生變化,則混合氣體的平均摩爾質量發生變化,當平均摩爾質量不變時,表明該反應已經達到平衡狀態,故③正確;④容器內N2 , H2 , NH3的濃度之比為1:3:2,無法判斷各組分的濃度是否變化,則無法判斷是否達到平衡狀態,故④錯誤;⑤單位時間內生成n mol NH3 , 同時生成N2 , H2共2n mol,無法判斷氮氣、氫氣的物質的量,則無法判斷平衡狀態,故⑤錯誤;
所以答案是:③;(3)反應達平衡時,混合氣體為: ![]() =32mol,其中NH3的物質的量為:32mol×25%=8mol;
=32mol,其中NH3的物質的量為:32mol×25%=8mol;
利用差量法計算:
N2(g)+ | 3H2(g) | 2NH3(g) | 物質的量減少△n | ||
1mol | 3mol | 2mol | 2mol | ||
轉化: | 4mol | 12mol | 8mol | 8mol |
故原混合氣體為:32mol+8mol=40mol,
由(1)知a=16mol,則b=40mol﹣16mol=24mol,
達到平衡時,N2和H2的轉化率之比α(N2):α(H2)= ![]() :
: ![]() =1:2,
=1:2,
所以答案是:1:2.
【考點精析】本題主要考查了化學平衡的計算的相關知識點,需要掌握反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%才能正確解答此題.


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:
【題目】(14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有著廣泛的用途.回答下列問題:
(1)畫出砷的原子結構示意圖 .
(2)工業上常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫.寫出發生反應的化學方程式 . 該反應需要在加壓下進行,原因是 .
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+ ![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
則反應As2O5(s)+3H2O(l)=2H3AsO4(s)的△H= .
(4)298K時,將20mL 3x molL﹣1 Na3AsO3、20mL 3x molL﹣1 I2和20mL NaOH溶液混合,發生反應:AsO33﹣(aq)+I2(aq)+2OH﹣AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)與反應時間(t)的關系如圖所示.
①下列可判斷反應達到平衡的是(填標號).
a.溶液的pH不再變化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再變化
d.c(I﹣)=y molL﹣1
②tm時,v正 v逆(填“大于”“小于”或“等于”).
③tm時v逆tn時v逆(填“大于”“小于”或“等于”),理由是 .
④若平衡時溶液的pH=14,則該反應的平衡常數K為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家最近在-100℃的低溫下合成了一種烴X,X分子中所有氫原子的化學環境沒有區別,其球棍模型如圖。下列說法中不正確的是

A. X的分子式為C5H4
B. X分子中有碳碳單鍵,也有碳碳雙鍵
C. 該烴X與等質量的甲烷相比,X燃燒時消耗的氧氣更多
D. X分子中的氫原子分布在兩個相互垂直的異面直線上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據問題填空:
(1)下列原子: ![]() C、147N、
C、147N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有種元素,種核素,和互為同位素.
U中共有種元素,種核素,和互為同位素.
(2)下列曲線分別表示元素的某種性質與核電荷數的關系(X為核電荷數,Y為元素的 有關性質).把與下面元素有關的性質相符的曲線標號填入相應的空格中: 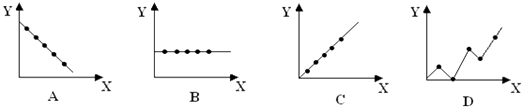
② 第ⅡA族元素的最外層電子數;
②第三周期元素的最高化合價;
③堿金屬單質的熔點
(3)陰離子的中子數為N:AXn﹣共有x個電子,則N= .
(4)有下列物質中NH3、Na2O、CO2、CaCl2、CCl4、N2、NaHCO3、NaOH、Na2O2、NH4Cl屬于電解質的有 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種元素,原子序數依次增大,A原子的最外層上有4個電子;B的陰離子和C的陽離子具有相同的電子層結構,兩元素的單質反應,生成一種淡黃色的固體E,D的L層電子數等于K、M兩個電子層上的電子數之和.
(1)A為 ,B為 ,C為 .
(2)E的電子式為 .
(3)寫出D的最高價氧化物的水化物和A單質反應的化學方程式
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組用下列裝置進行乙醇催化氧化的實驗. 
(1)實驗過程中銅網出現黑色和紅色交替的現象. ①紅色變成黑色的反應是:2Cu+O22CuO;
②黑色變為紅色的化學方程式為: .
在不斷鼓入空氣的情況下,熄滅酒精燈,反應仍能繼續進行,說明該乙醇催化反應是反應.
(2)甲和乙兩個水浴作用不相同.甲的作用是;乙的作用是 .
(3)反應進行一段時間后,試管a中能收集到多種物質,它們是 . (任寫兩種即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值,下列敘述正確的是( )
A.將1 mol Cl2通入到水中,則N(HClO)+N(Cl﹣)+N(ClO﹣)=2NA
B.常溫常壓下,3.0 g含甲醛的冰醋酸中含有的原子總數為0.4NA
C.標準狀況下,2.24 L的CCl4中含有的C﹣Cl鍵數為0.4NA
D.將CO2通過Na2O2使其增重a克時,反應中轉移的電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據相關報道,在日本生產的嬰兒奶粉中檢測到銫的人工放射性核素.下列說法正確的是( ) 
A.133Cs的核電荷數為133
B.133Cs+核外有54個電子
C.133Cs的質子數比137 Cs少4個
D.銫與水的反應比鈉與水的反應緩慢
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com