
汽車尾氣已成為重要的空氣污染物。
(1)汽車內燃機工作時引起反應:N2(g)+O2(g)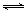 2NO(g),是導致汽車尾氣中含有NO的原因之一。T ℃時,向5L密閉容器中充入8mol N2和9molO2,5min后達平衡時NO物質的量為6mol,計算該條件下的平衡常數(寫出計算過程)。
2NO(g),是導致汽車尾氣中含有NO的原因之一。T ℃時,向5L密閉容器中充入8mol N2和9molO2,5min后達平衡時NO物質的量為6mol,計算該條件下的平衡常數(寫出計算過程)。
(2)H2或CO可以催化還原NO以達到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) △H = -571.6kJ/mol
則H2(g)與NO(g)反應生成N2(g)和H2O(l)的熱化學方程式為 。
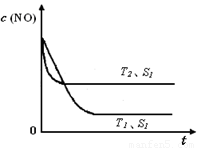
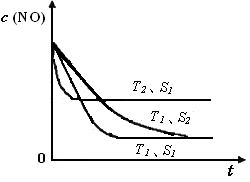
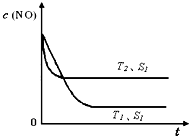
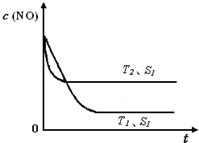
②當質量一定時,增大固體催化劑的表面積可提高化學反應速率。右圖是反應:2NO(g) + 2CO(g) 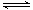 2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線,據此判斷該反應的△H
0 (填“>”、“<”或“無法確定”)。若催化劑的表面積S1>S2 ,在圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線,據此判斷該反應的△H
0 (填“>”、“<”或“無法確定”)。若催化劑的表面積S1>S2 ,在圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
(10分)(1)
N2(g) + O2(g) 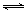 2NO(g)
2NO(g)
起始濃度(mol·L-1)1.6 1.8 0
轉化濃度(mol·L-1)0.6 0.6 1.2 (2分)
平衡濃度(mol·L-1)1.0 1.2 1.2
平衡常數K=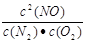 (1分)
(1分)
=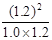 =1.2
(1分)
=1.2
(1分)
【①計算結果正確但三段式不完整或不寫平衡常數表達式均扣1分;②用物質的量計算平衡常數即便結果正確也只能得過程2分。】
(2)①2H2(g)+ 2NO(g)= N2(g)+2H2O(l) △H = -752.1kJ/mol(2分)
【①不標或標錯物質狀態或△H計算錯誤不得分;②計量數和△H成比例增加或減少也得2分】
②< (2分);【填“小于”扣1分】
 (2分)
(2分)
【①曲線畫錯不得分:注意起始點、變化趨勢、拐點;②曲線正確但不標條件扣1分。】
【解析】
試題分析:(1)(1) N2(g)
+ O2(g) 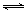 2NO(g)
2NO(g)
起始濃度(mol·L-1)1.6 1.8 0
轉化濃度(mol·L-1)0.6 0.6 1.2
平衡濃度(mol·L-1)1.0 1.2 1.2
平衡常數K=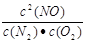 =
=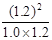 =1.2;(2)根據蓋斯定律,已知的前一個熱化學方程式減去后一個熱化學方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l)
△H = -752.1 kJ·mol-1;(3)讀圖,兩條曲線先后達到平衡,說明T2>T1,即升高溫度,平衡時c(NO)增大,由于升溫平衡向吸熱方向移動,c(NO)增大說明平衡向逆反應方向移動,則逆反應是吸熱反應,所以正反應是放熱反應,△H<0;畫圖要點:S1變為S2,即減小催化劑表面積,反應速率減小,單位時間內NO的變化濃度減小,則T1、S2的曲線位于T1、S1曲線的右邊;催化劑不能使平衡移動,所以NO的平衡濃度與T1、S1曲線相同,只是達到平衡的時間比T1、S1曲線增大。
=1.2;(2)根據蓋斯定律,已知的前一個熱化學方程式減去后一個熱化學方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l)
△H = -752.1 kJ·mol-1;(3)讀圖,兩條曲線先后達到平衡,說明T2>T1,即升高溫度,平衡時c(NO)增大,由于升溫平衡向吸熱方向移動,c(NO)增大說明平衡向逆反應方向移動,則逆反應是吸熱反應,所以正反應是放熱反應,△H<0;畫圖要點:S1變為S2,即減小催化劑表面積,反應速率減小,單位時間內NO的變化濃度減小,則T1、S2的曲線位于T1、S1曲線的右邊;催化劑不能使平衡移動,所以NO的平衡濃度與T1、S1曲線相同,只是達到平衡的時間比T1、S1曲線增大。
考點:本題考查化學平衡常數、蓋斯定律、熱化學方程式、放熱反應、吸熱反應、催化劑對反應速率和平衡移動的影響規律等。


 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:
 (2012?佛山二模)2012年2月27日深圳宣稱進入“200萬輛汽車時代”,汽車尾氣已成為重要的空氣污染物.
(2012?佛山二模)2012年2月27日深圳宣稱進入“200萬輛汽車時代”,汽車尾氣已成為重要的空氣污染物.查看答案和解析>>
科目:高中化學 來源: 題型:
| c2(NO) |
| c(N2)c(O2) |
| c2(NO) |
| c(N2)c(O2) |
 ①由此推知,反應 N2(g)+O2(g)?2NO(g)為(填“吸熱”或“放熱”)
①由此推知,反應 N2(g)+O2(g)?2NO(g)為(填“吸熱”或“放熱”)查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 汽車尾氣已成為重要的空氣污染物.
汽車尾氣已成為重要的空氣污染物.| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需 時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com