
【題目】已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。回答有關中和反應的問題。
(1)用0.1 mol Ba(OH)2配成稀溶液與足量稀硝酸反應,能放出________________kJ熱量。

(2)如圖裝置中儀器A的名稱是____________,作用是__________________________;
碎泡沫塑料的作用是_____________________________;
要重復進行三次實驗的目的是 ____________________。
(3)若通過實驗測定中和熱的ΔH,其結果常常大于-57.3 kJ·mol-1,其原因可能是 ____________。
(4)用相同濃度和體積的氨水(NH3·H2O)代替NaOH溶液進行上述實驗,測得的中和熱的數值會__________(填“偏大”、“偏小”、“無影響”)。
(5)將V1 mL 1.00 mol/L HCl溶液和V2 mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖所示(實驗中始終保持V1+V2=50 mL)。下列敘述正確的是(____)

A.做該實驗時環境溫度為22 ℃
B.該實驗表明化學能可以轉化為熱能
C.NaOH溶液的濃度約為1.00 mol·L-1
D.該實驗表明有水生成的反應都是放熱反應
【答案】11.46 環形玻璃攪拌棒 攪拌,使溶液充分混合 減少實驗過程中的熱量損失 減少實驗過程產生的誤差 實驗中有少量熱量損失 偏小 B
【解析】
(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJmol-1可知生成1molH2O放出熱量為57.3kJ,然后根據生成的水的物質的量與熱量成正比求出熱量;
(2)根據儀器的圖形判斷儀器名稱;中和熱測定時應避免熱量散失,據此分析解答;
(3)若保溫效果不好,有熱量散失,求得的中和熱將會偏大;
(4)NH3H2O為弱電解質,弱電解質的電離需要吸熱,據此分析判斷;
(5)A.從圖示觀察起始溫度即為實驗時環境溫度;B.根據圖示所測溶液溫度變化進行分析;C.根據c酸V酸=c堿V堿進行計算;D、根據一個反應無法得出反應的結論,據此分析判斷。
(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJmol-1可知,生成1molH2O放出熱量為57.3kJ,0.1mol Ba(OH)2配成稀溶液與足量稀硝酸反應可得0.2molH2O,所以放出的熱量為57.3kJ×0.2=11.46kJ,故答案為:11.46;
(2)根據裝置圖,儀器A為環形玻璃攪拌棒,可起到攪拌,使溶液充分混合的目的;中和熱測定實驗成敗的關鍵是保溫工作,大小燒杯之間填滿碎泡沫塑料可以起到隔熱,減少熱量散失的作用;進行三次實驗可以減少實驗過程產生的誤差,故答案為:環形玻璃攪拌棒;攪拌,使溶液充分混合;隔熱,減少熱量散失;減少實驗過程產生的誤差;
(3)若保溫效果不好,有熱量散失,求得的中和熱將會偏大,△H大于-57.3kJmol-1,故答案為:實驗過程中有熱量散失;
(4)NH3H2O為弱堿,電離過程為吸熱過程,用相同濃度和體積的氨水(NH3H2O)代替NaOH溶液進行上述實驗,測得的中和熱的數值偏小,故答案為:偏小;
(5)A.從圖示觀察起始溫度即為實驗時環境溫度,因此該實驗開始時溫度約為21℃,故A錯誤;B.由圖示可以看出該反應過程放出熱量,表明化學能可能轉化為熱能,故B正確;C、恰好反應時參加反應的鹽酸體積為30mL,則堿的體積為20mL,c(NaOH)=![]() =1.5mol/L,故C錯誤;D.實驗表明該反應為放熱反應,其他有水生成的反應不一定是放熱反應,如氫氧化鋇晶體與氯化銨固體的反應為吸熱反應,故D錯誤;故選B。
=1.5mol/L,故C錯誤;D.實驗表明該反應為放熱反應,其他有水生成的反應不一定是放熱反應,如氫氧化鋇晶體與氯化銨固體的反應為吸熱反應,故D錯誤;故選B。


 小學暑假作業東南大學出版社系列答案
小學暑假作業東南大學出版社系列答案 津橋教育暑假拔高銜接廣東人民出版社系列答案
津橋教育暑假拔高銜接廣東人民出版社系列答案 波波熊暑假作業江西人民出版社系列答案
波波熊暑假作業江西人民出版社系列答案 學而優暑期銜接南京大學出版社系列答案
學而優暑期銜接南京大學出版社系列答案科目:高中化學 來源: 題型:
【題目】硫及其化合物有許多用途。請回答下列問題。
(1)基態硫離子價層電子的軌道表達式為___________,其電子填充的最高能級的軌道數為___________。
(2)常見含硫的物質有單質硫(S8)、SO2、Na2S、K2S等,四種物質的熔點由高到低的順序依次為___________,原因是___________。
(3)方鉛礦(即硫化鉛)是一種比較常見的礦物,酸溶反應為:PbS+4HCl(濃)=H2[PbCl4]+H2S↑,則H2[PbCl4]中配位原子是_________,第一電離能I1(Cl)___________I1(S)(填“>”、“<”或¨=”),H2S中硫的雜化方式為_______,下列分子空間的構型與H2S相同的有___________。
A.H2O B.SO3 C.O3 D.CH4
(4)方鉛礦的立方晶胞如圖所示,硫離子采取面心立方堆積,鉛離子填在由硫離子形成的___________空隙中。已知晶體密度為ρg·cm-3,阿伏加德羅常數的值為NA,則晶胞中硫離子與鉛離子最近的距離為___________nm。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.氮氧化物的存在會破壞地球環境,人們一直在積極探索改善大氣質量的有效措施。已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5kJ·mol-1
2NO(g) △H=+181.5kJ·mol-1
(1)氮氧化物是形成臭氧層空洞光化學煙霧、_______(列舉一種)等大氣污染現象的物質之一。
(2)某科研小組嘗試利用固體表面催化工藝進行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分別表示N2、NO、O2和固體催化劑,在固體催化劑表面分解NO的過程如圖所示。從吸附到解吸的過程中,能量狀態最低的是_______(填字母序號)。
分別表示N2、NO、O2和固體催化劑,在固體催化劑表面分解NO的過程如圖所示。從吸附到解吸的過程中,能量狀態最低的是_______(填字母序號)。

(3)溫度為T1時,在容積為1L的恒容密閉容器中充入0.6molNO2,僅發生反應2NO2(g)![]() 2NO(g)+O2(g) △H>0,達平衡時c(O2)=0.2mol·L-1,則該溫度下反應的平衡常數為______。實驗測得:v正=v(NO2)消耗=k正c2(NO2),v逆= v (NO2)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆為速率常數,僅受溫度影響。當溫度改變為T2時,若k正=k逆,則T1_____T2(填“>”或“<”)。
2NO(g)+O2(g) △H>0,達平衡時c(O2)=0.2mol·L-1,則該溫度下反應的平衡常數為______。實驗測得:v正=v(NO2)消耗=k正c2(NO2),v逆= v (NO2)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆為速率常數,僅受溫度影響。當溫度改變為T2時,若k正=k逆,則T1_____T2(填“>”或“<”)。
Ⅱ.氮氧化物(NOx)是電廠主要排放的污染物之一。工業上采用氨脫硝處理后排放,原理如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1;
4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1;
②4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H2=akJ·mol-1;
5N2(g)+6H2O(g) △H2=akJ·mol-1;
當反應溫度過高時,NH3發生氧化反應:
③4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1。
4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1。
(4)反應②中的a=______。
(5)反應②中,常用的催化劑有Cr2O3和Fe2O3,Cr2O3的催化效率更好一些。下列表示兩種催化劑在反應②催化過程中的能量變化示意圖合理的是______(填選項字母)。

Ⅲ.利用電解法處理高溫空氣中稀薄的NO(O2濃度約為NO濃度的10倍),裝置示意圖如下,固體電解質可傳導O2-
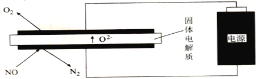
(6)陰極的電極反應式為______。
(7)消除一定量的NO所消耗的電量遠遠大于理論計算量,可能的原因是(不考慮物理因素)______。
(8)通過更換電極表面的催化劑可明顯改善這一狀況,利用催化劑具有______性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學利用如圖所示的實驗裝置進行鐵與水蒸氣的實驗,并研究鐵及其化合物的部分性質。
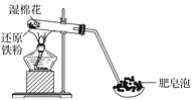
請回答下列問題:
(1)硬質試管中發生反應的化學方程式為______________________。
(2)該同學為確定反應后硬質試管中固體物質的成分,設計了如下實驗方案:
①待硬質試管冷卻后,取少許其中的固體物質溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液變紅色,則說明硬質試管的固體物質中一定有___,可能有___;若溶液未變紅色,則說明硬質試管中固體物質的成分是___________。
(3)該同學按(2)中所述實驗方案進行了實驗,結果溶液未變紅色,原因是________(用離子方程式表示)。
(4)該同學馬上另取少量溶液B,使其與NaOH溶液反應。若按圖所示操作,可觀察到試管中先生成白色沉淀,后沉淀迅速變成灰綠色,最后變成紅褐色的現象,請寫出白色沉淀變為紅褐色的過程中所發生反應的化學方程式:_________________。

(5)一段時間后,該同學發現(3)中未變紅的溶液變成紅色,說明Fe2+具有_____性。由此可知,實驗室中含有Fe2+的鹽溶液需現用現配制的原因是______,并且配制含Fe2+的鹽溶液時應加入少量_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物J是一種防止血管中血栓形成與發展的藥物,其合成路線如圖所示(部分反應條件略去)。

請回答下列問題:
(1)B的名稱為______________,反應⑥的反應類型是__________。
(2)J含有_______種官能團。F的結構簡式是_____________。
(3)反應③的化學方程式為____________________________________________-。
(4)寫出同時滿足下列條件的F的同分異構體的結構簡式:______________(至少寫兩種)。
①苯環上只有兩個處于對位的取代基;
②1 mol該有機物能與含2 mol NaOH的溶液恰好完全反應。
(5)參照D的合成路線,設計一種以![]() 為原料制備
為原料制備 的合成路線__________。
的合成路線__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]與pH關系如圖所示。下列說法正確的是

A. A點對應溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃時,HA酸的電離常數為1. 0× 10-5.3
C. B點對應的NaOH溶液體積為10 mL
D. 對C點溶液加熱(不考慮揮發),則c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、鉻及其相關化合物用途非常廣泛。回答下列問題:
(1)基態N原子的核外電子排布式為___,Cr位于元素周期表第四周期___族。
(2) Cr與K位于同一周期且最外層電子數相同,兩種元素原子第一電離能的大小關系為___;Crcl3的熔點(83℃)比CrF3的熔點(1100℃)低得多,這是因為___。
(3) Cr的一種配合物結構如圖所示:

①陰離子C1O4-的空間構型為___形。
②配離子中,中心離子的配位數為___,N與中心原子形成的化學鍵稱為___鍵。
③配體H2 NCH2 CH2 NH2(乙二胺)中碳原子的雜化方式是______ ,分子中三種元素電負性從大到小的順序為___
(4)氮化鉻的熔點為1770℃,它的一種晶體的晶胞結構如圖所示,其密度為5. 9 g·cm -3,氮化鉻的晶胞邊長為___(列出計算式)nm.

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硫原子的質量是a g,12C原子的質量是b g,若NA表示阿伏加德羅常數,則下列說法中正確的是
①該硫原子的相對原子質量為12a/b ②m g該硫原子的物質的量為m/aNA mol
③12C原子的摩爾質量是12g或bNA g ④a g該硫原子所含的電子數為16
A.①③④B.②③④C.①②④D.①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物X的結構簡式如圖,下列說法不正確的是

A. X分子式為C10H20O,它是環己醇的同系物
B. X的一氯取代物有6種
C. X能使酸性高錳酸鉀溶液褪色
D. 在一定條件下,X能發生消去反應生成2種烯烴(不考慮立體異構)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com