
【題目】以方鉛礦(PbS)為原料制備鉛蓄電池的電極材料的工藝流程如圖所示: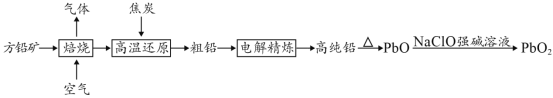
請回答下列問題:
(1)“焙燒”生成的氣體直接排放可能造成的環境問題是____________,“焙燒”前須將方鉛礦研磨粉粹的目的是________________________________。
(2)電解時,如c(Pb2+)遠大于c(H+),則Pb2+優先于H+放電,工業上應用此原理可對鉛進行電解精煉。“粗鉛”的雜質主要有鋅、鐵、銅、銀等,則陽極泥的主要成分為_________。
(3)寫出制備PbO2的離子方程式________________________。
(4)已知部分含鉛化合物的Ksp如下表所示:
物質 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①鉛與稀鹽酸反應產生少量氣泡后反應終止,原因是_____________________。
②Pb(NO3)2是強酸弱堿鹽,氫硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105時可以認為反應基本完全,通過計算判斷向Pb(NO3)2溶液中通入H2S氣體能否形成PbS沉淀___________________。(要求寫出計算過程)
【答案】酸雨 增大方鉛礦與空氣的接觸面積,加快化學反應速率 銅、銀 ClO-+PbO=PbO2+Cl- PbCl2覆蓋在鉛表面,阻止反應的進一步進行 假設能發生反應:Pb2++H2S=PbS↓+2H+,該反應的平衡常數![]() ,反應可進行完全,故有PbS沉淀生成
,反應可進行完全,故有PbS沉淀生成
【解析】
方鉛礦中通入空氣焙燒,發生反應2PbS+3O2![]() 2SO2+2PbO,加入焦炭還原,發生反應PbO+C
2SO2+2PbO,加入焦炭還原,發生反應PbO+C![]() Pb+CO↑,得到粗鉛,通過電解精煉得到純Pb,Pb加熱得到PbO,將PbO投入NaClO溶液中得到PbO2,發生的反應為ClO-+PbO═PbO2+Cl-,據此分析解答。
Pb+CO↑,得到粗鉛,通過電解精煉得到純Pb,Pb加熱得到PbO,將PbO投入NaClO溶液中得到PbO2,發生的反應為ClO-+PbO═PbO2+Cl-,據此分析解答。
(1)焙燒時發生的反應為2PbS+3O2![]() 2SO2+2PbO,生成的氣體是SO2,可導致酸雨,“焙燒”前須將方鉛礦研磨粉粹,可增大方鉛礦與空氣的接觸面積,加快化學反應速率,故答案為:酸雨;增大方鉛礦與空氣的接觸面積,加快化學反應速率;
2SO2+2PbO,生成的氣體是SO2,可導致酸雨,“焙燒”前須將方鉛礦研磨粉粹,可增大方鉛礦與空氣的接觸面積,加快化學反應速率,故答案為:酸雨;增大方鉛礦與空氣的接觸面積,加快化學反應速率;
(2)“粗鉛”的雜質主要有鋅,鐵,銅,銀等,電解精煉時,粗Pb作陽極、純Pb作陰極,Zn、Fe比Pb活潑,所以陽極上Zn、Fe和Pb失電子生成離子進入溶液,鉛的活潑性大于銅、銀,鉛先放電,陽極泥的主要成分為銅、銀,故答案為:銅、銀;
(3),根據流程圖,制備PbO2的離子方程式為ClO-+PbO=PbO2+Cl-,故答案為:ClO-+PbO=PbO2+Cl-;
(4)①鉛與稀鹽酸反應生成氯化鉛和氫氣,生成的氯化鉛難溶于水,PbCl2覆蓋在鉛表面,阻止反應的進一步進行,因此產生少量氣泡后反應終止,故答案為:PbCl2覆蓋在鉛表面,阻止反應的進一步進行;
②假設能發生反應Pb2++H2S═PbS↓+2H+,該反應的電離平衡常數K=![]() =
=![]() =1.0×107>105,所以該反應能進行完全,所以有PbS沉淀生成,故答案為:假設能發生反應Pb2++H2S═PbS↓+2H+,該反應的電離平衡常數K=
=1.0×107>105,所以該反應能進行完全,所以有PbS沉淀生成,故答案為:假設能發生反應Pb2++H2S═PbS↓+2H+,該反應的電離平衡常數K=![]() =
=![]() =1.0×107>105,反應能進行完全,有沉淀PbS生成。
=1.0×107>105,反應能進行完全,有沉淀PbS生成。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】A、B都是芳香族化合物,![]() 水解得到
水解得到![]() 和1mol醋酸。A、B的相對分子質量都不超過200,完全燃燒都只生成CO2和H2O。且B分子中碳和氫元素總的質量分數為65.2%。A溶液具有酸性,不能使氯化鐵溶液顯色。
和1mol醋酸。A、B的相對分子質量都不超過200,完全燃燒都只生成CO2和H2O。且B分子中碳和氫元素總的質量分數為65.2%。A溶液具有酸性,不能使氯化鐵溶液顯色。
(1)A、B相對分子質量之差為____________________。
(2)1個B中應該有____________________個氧原子。
(3)A的分子式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種物質直接的轉化如圖所示,其中不能一步實現的是( )

A | B | C | D | |
X | C | NaOH | CH3CH2OH | N2 |
Y | CO | Na2CO3 | CH3CHO | NH3 |
Z | CO2 | NaHCO3 | CH3COOH | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,列出10種元素在周期表中的位置。用化學符號回答下列問題:
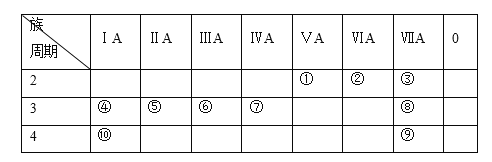
(1)10種元素中,化學性質最活潑的金屬是________。
(2)④、⑤、⑥兩種元素最高價氧化物對應的水化物中,堿性最強的是________。
(3)③、④兩種元素形成的離子,離子半徑由大到小的順序是________。
(4)④和⑨兩種元素形成化合物的化學式為________,該化合物燃燒時的焰色為________,該化合物溶液與元素⑧的單質反應的離子方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香蘭素是重要的香料之一,它可由丁香酚經多步反應合成。
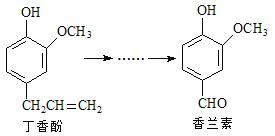
有關上述兩種化合物的說法正確的是
A. 常溫下,1mol丁香酚只能與1molBr2反應
B. 丁香酚不能使FeCl3溶液發生顯色反應
C. 1mol香蘭素最多能與3mol氫氣發生加成反應
D. 香蘭素分子中至少有12個原子共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于水的電離平衡H2O![]() H++OH-,下列敘述正確的是
H++OH-,下列敘述正確的是
A.加熱,Kw增大,pH不變
B.向水中加入少量鹽酸,c(H+)增大,Kw不變
C.向水中加入少量CH3COONa固體,平衡逆向移動,c(H+)降低
D.向水中加入NaOH固體,平衡逆向移動,c(OH-)降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2L的恒容密閉容器中發生反應xA(g)+yB(g) ![]() zC(g),圖1表示200℃時容器中A、B、C物質的量隨時間的變化,圖2表示溫度與C的體積分數的變化關系,則下列結論正確的是
zC(g),圖1表示200℃時容器中A、B、C物質的量隨時間的變化,圖2表示溫度與C的體積分數的變化關系,則下列結論正確的是
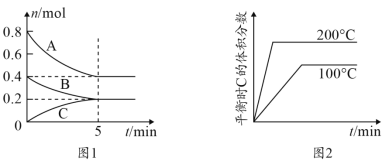
A.由圖可知該反應為2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.200℃,該反應的平衡常數為25
C.200℃時,反應從開始到平衡的平均速率v(B)=0.04mol·L-1·min-1
D.當外界條件由200℃降溫到100℃,原平衡被破壞,且正逆反應速率均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究人員研制出一種新型儲備電源-鋰水電池(結構如圖,高硅鑄鐵為惰性輔助電極),使用時加入水即可放電。下列關于該電池工作時的說法正確的是
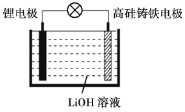
A.高硅鑄鐵發生氧化反應B.OH-向高硅鑄鐵電極移動
C.負極的電極反應式為Li-e-=Li+D.電流的方向:鋰電極→導線→高硅鑄鐵電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鋁陶瓷常用于厚膜集成電路,制備氧化鋁陶瓷的工藝流程如圖所示,回答下列問題。
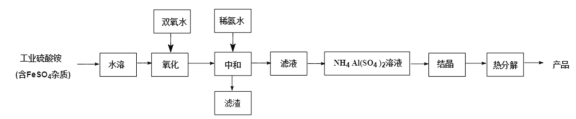
(1)“氧化”步驟發生的離子方程式為:________, 使用雙氧水作氧化劑優點為:______________。
(2)“熱分解”得到的產物除了氧化鋁外,還有 NH3、N2、SO2、SO3、H2O 生成,則氧化 產物和還原產物的物質的量之比為______________。
(3)銨明礬晶體的化學式為NH4Al(SO4)2·12H2O,“熱分解”步驟中,其各溫度段內受熱“失
重計算值( 失重計算值(%)![]() )如表所示:
)如表所示:
溫度區間(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重計算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通過上述數據經粗略計算可判斷,在______________溫度區間銨明礬基本上失去了全部結晶水。
(4)“結晶”步驟中常采用的操作是_____
(5)該流程中常使用過量的工業硫酸銨,利用硫酸銨水解使溶液顯酸性抑制硫酸鋁水解, 這樣做的目的是:______________。
(6)通常認為金屬離子濃度等于 1×10-5mol/L 即可認為沉淀完全,試計算常溫下“中和”步 驟中需要調節溶液 pH=______________(保留一位小數,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com