
科目:高中化學 來源: 題型:
20℃時,NaCl溶解于水的實驗數據如下表所
| 實驗序號 | 加入水的質量/g | NaCl質量/g | 未溶的NaCl質量/g |
| ① | 10 | 4 | 2 |
| ② | 20 | 4 | 0 |
| ③ | 30 | 4 | 0 |
A.實驗①所得溶液為飽和溶液 B.實驗②所得溶液為飽和溶液
C.20℃時NaCl的溶解度為2g D.實驗③所得溶液的溶質質量分數為13.3%
查看答案和解析>>
科目:高中化學 來源: 題型:
下列方法中,正確的是
A.用濕潤的紅色石蕊試紙檢驗氨氣
B.在樣品溶液中先加入硝酸銀溶液,再加入稀硝酸,若白色沉淀存在,則樣品中含有Cl—
C.將熟石灰和氯化銨混合加熱,可以制備氨氣
D.將燒瓶中的濃氨水加熱
查看答案和解析>>
科目:高中化學 來源: 題型:
下列敘述錯誤的是( )
A.用金屬鈉可區分乙醇和乙醚 B.用高錳酸鉀酸性溶液可區分己烷和3-己烯
C.用水可區分苯和溴苯 D.用新制的銀氨溶液可區分甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化學 來源: 題型:
具有顯著抗癌活性的10羥基喜樹堿的結構如圖所示。
下列關于10羥基喜樹堿的說法正確的是
A. 分子式為C20H16N2O5
B. 不能與FeCl3溶液發生顯色反應
C. 不能發生酯化反應
 D. 一定條件下,1 mol該物質最多可與1 mol NaOH反應
D. 一定條件下,1 mol該物質最多可與1 mol NaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
乙醇是重要的有機化工原料,可由乙烯氣相直接水合法間接水合法生產,回答下列問題:
(1)間接水合法是指先將乙烯與濃硫酸反應生成硫酸氫乙酯(C2H5OSO3H),再水解生成乙醇,寫出相應反應的化學方程式__________________________________。
(2)已知:
甲醇脫水反應 2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-23.9kJ/mol
甲醇制烯烴反應 2CH3OH(g)=C2H4(g)+2H2O(g) △H=-29.1kJ/mol
乙醇異構化反應 C2H5OH(g)=CH3OCH3(g) △H=+50.7kJ/mol
則乙烯氣相直接水合反應C2H4(g)+2H2O(g)= C2H5OH(g)的△H=________kJ/mol,與間接水合法相比,氣相直接水合法的優點是___________________________。
(3)下圖為氣相水合法中乙烯的平衡轉化率與溫度、壓強的關系(n(H2O):n(C2H4)=1:1)。
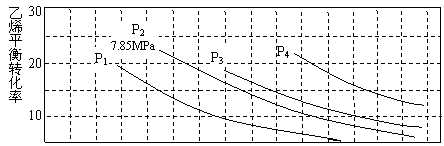 |
|
①列算式計算乙烯水合制乙醇反應在圖中A點的平衡常數Kp=_______________
_____________。(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
②圖中壓強(P1、P2、P3、P4)的大小順序為___________,理由是_________________。
③氣相直接水合法常采用的工藝條件為:磷酸/硅藻土為催化劑,反應溫度290℃、
壓強6.9MPa,n(H2O):n(C2H4)=0.6:1。乙烯的轉化率為5%,若要進一步提高乙烯轉化率,除了可以適當改變溫度和壓強外,還可以采取的措施有___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com