
下表是相同溫度下三種酸的一些數據,下列判斷正確的是
A.在相同溫度下, > > > > |
B.室溫時,若在NaZ溶液中加水,則 / / · · 的比值變小,若加少量鹽酸,則比值變大 的比值變小,若加少量鹽酸,則比值變大 |
C.等物質的量濃度的NaX、NaY和NaZ的混合溶液,則 < < < < |
D.在相同溫度,從HX的數據可以說明:弱電解質溶液濃度越低,電離度越大,且 > > > > =0.01 =0.01 |
A
解析試題分析:電離度是弱電解質達到電離平衡時已經電離的電解質分子濃度占電解質分子總濃度的百分比。它不僅以溫度有關,還與電解質的濃度有關。電離平衡常數是弱電解質達到電離平衡時電離產生的各種離子濃度的乘積與未電離的電解質分子的濃度的比。它只與溫度有關,而與濃度無關。A.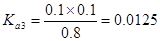 ;
;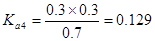 ;
;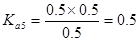 所以在相同溫度下,
所以在相同溫度下, >
> >
> .正確.B.HZ為弱酸,所以NaZ為強堿弱酸鹽,在加水的過程中平衡Z-+H2O
.正確.B.HZ為弱酸,所以NaZ為強堿弱酸鹽,在加水的過程中平衡Z-+H2O HZ+OH-正向移動,促進了Z-的水解,Z-的水解程度增大,c(Z-)減小,c(HZ)、c(OH-)盡管平衡正向移動使它們的濃度有所增加,但是稀釋作用遠大于平衡移動增加的濃度,總的來說,濃度還是減小,所以c(Z-)/ c(HZ)·c(OH-)的比值變小。若加少量鹽酸,發生反應:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)減小和c(OH-)減小,比值也變小。錯誤。C.在相同的溫度下,在相同溫度下,
HZ+OH-正向移動,促進了Z-的水解,Z-的水解程度增大,c(Z-)減小,c(HZ)、c(OH-)盡管平衡正向移動使它們的濃度有所增加,但是稀釋作用遠大于平衡移動增加的濃度,總的來說,濃度還是減小,所以c(Z-)/ c(HZ)·c(OH-)的比值變小。若加少量鹽酸,發生反應:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)減小和c(OH-)減小,比值也變小。錯誤。C.在相同的溫度下,在相同溫度下, >
> >
> 。電離平衡常數越大,等物質的量濃度的酸的酸性就越強。則其等物質的量濃度的NaX、NaY和NaZ的混合溶液,酸根離子的水解程度就越小,離子濃度就越大。則
。電離平衡常數越大,等物質的量濃度的酸的酸性就越強。則其等物質的量濃度的NaX、NaY和NaZ的混合溶液,酸根離子的水解程度就越小,離子濃度就越大。則 >
> >
> 。D. 在相同溫度,從HX的數據可以說明:弱電解質溶液濃度越低,電離產生的離子再重新結合形成電解質分子的幾率就越小,電離度越大。但是電解質的電離平衡常數只與溫度有關,而與濃度的大小無關。所以
。D. 在相同溫度,從HX的數據可以說明:弱電解質溶液濃度越低,電離產生的離子再重新結合形成電解質分子的幾率就越小,電離度越大。但是電解質的電離平衡常數只與溫度有關,而與濃度的大小無關。所以 =
= =
=  。錯誤。
。錯誤。
考點:考查電離度、電離平衡常數與濃度、溫度的關系的知識。


科目:高中化學 來源: 題型:單選題
在25℃下,將a mol·L-1的CH3COONa與0.02 mol·L-1的鹽酸等體積充分混合,反應后測得溶液pH=7,則:
(1)a 0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)= mol·L-1,c(CH3COOH)= mol·L-1;
(3)CH3COOH的電離平衡常數Ka= (用含a的代數式表達)。
(4)反應后溶液中各種離子濃度由大到小順序是
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液顯酸性,關于NaHC2O4溶液中離子濃度關系的敘述不正確的是( )
| A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4) |
| B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4) |
| C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-) |
| D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知室溫時,0.1 mol/L某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是( )
| A.該溶液的pH=4 |
| B.升高溫度,溶液的pH增大 |
| C.此酸的電離平衡常數約為1×10-7 |
| D.由HA電離出的c(H+)約為水電離出的c(H+)的106倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于電解質溶液的敘述正確的是 ( )。
| A.常溫下,同濃度的Na2CO3與NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常溫下,pH=7的NH4Cl與氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH與體積均相同的鹽酸和醋酸,消耗NaOH溶液的物質的量相同 |
| D.將pH=4的鹽酸稀釋后,溶液中所有離子的濃度均降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
化學平衡常數(K)、弱酸的電離平衡常數(Ka)、難溶物的溶度積常數(Ksp)是判斷物質性質或變化的重要的平衡常數。下列關于這些常數的說法中,正確的是( )
| A.平衡常數的大小與溫度、濃度、壓強、催化劑等有關 |
| B.當溫度升高時,弱酸的電離平衡常數Ka變小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判斷AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能夠發生 |
| D.Ka(HCN)<Ka(CH3COOH),說明物質的量濃度相同時,氫氰酸的酸性比醋酸強 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關說法正確的是( )
| A.常溫下,0.1 mol/L NH4Cl溶液加蒸餾水稀釋,溶液的pH不斷增大,但無限接近7 |
| B.25 ℃時,溶液中水電離出的c(H+)和水電離出的c(OH-)的乘積一定等于10-14 |
| C.pH=6的純水中,c(OH-)=10-8 mol·L-1 |
| D.稀釋0.01 mol·L-1的醋酸溶液時,溶液中所有的離子濃度均減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下,將a mol/L的MOH(可溶性弱堿)與b mol/L鹽酸等體積混合,已知相同條件下MOH的電離程度大于M+的水解程度,則下列有關推論不正確的是( )
| A.若混合后溶液pH=7,則c(M+)=c(Cl-) |
| B.若b=2a,則c(Cl-)>c(M+)>c(H+)>c(OH-) |
| C.若a=2b,則c(M+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液滿足c(H+)=c(OH-)+c(MOH),則可推出a=b |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
今有室溫下四種溶液,有關敘述不正確的是( )
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸 | 鹽酸 |
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com