
【題目】將8.34 g FeSO4·7H2O樣品隔絕空氣加熱脫水,其熱重曲線(樣品質量隨溫度變化的曲線)如圖所示。則下列說法不正確的是

A. 在100℃時,M的化學式為FeSO4·4H2O
B. FeSO4·7H2O晶體中有4種不同結合力的水分子
C. FeSO4·H2O存在的最高溫度為373℃
D. 380℃的P加熱至650℃時的化學方程式為:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【答案】B
【解析】試題分析:8.34 g FeSO4·7H2O 的物質的量是0.03mol。A、在100℃時,M的質量為6.72g,減少了1.62g水,剩余0.12mol的水,所以FeSO4與H2O的物質的量比是1:4,正確;B、晶體中水分子的結合力是相同的,錯誤;C、FeSO4·H2O中水的物質的量為0.03mol,其質量是5.1g,所以由圖可知FeSO4·H2O存在的最高溫度為373℃,正確;D、P點對應的物質的質量是4.56g,為FeSO4的質量,Q點的質量是2.4g為Fe2O3的質量,所以從P到Q發生反應的化學方程式為:2FeSO4![]() Fe2O3+SO2↑+SO3↑,正確,答案選B。
Fe2O3+SO2↑+SO3↑,正確,答案選B。


 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案 新思維小冠軍100分作業本系列答案
新思維小冠軍100分作業本系列答案 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數,下列敘述中正確的是
A. 常溫下64 g S4和S8混合物中含有原子數為2NA
B. 標準狀況下,22.4LHF中含電子數為10NA
C. 標準狀況時,2.24LNO和1.12LO2于密閉容器中充分反應后,其分子數為0.1NA
D. 足量鐵在1mol氯氣中加熱反應,鐵失去的電子數為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質A~F是我們熟悉的單質或化合物,其中A、B均是常見的金屬,且B的合金用量最大;E在常溫下是黃綠色氣體;在適當的條件下,它們之間可以發生如下圖所示的轉化。

試回答下列問題:
⑴ A的化學式是____________;
⑵ 反應F→D的化學方程式是______________________________________。
⑶ 檢驗F中金屬陽離子的常用方法是___________________________________。
⑷ 物質B與鹽酸反應的離子方程式是_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學一選修5:有機化學基礎】
有機高分子化合物G的合成路線如下:

已知:
①A既能與NaHCO3溶液反應,又能與FeCl3溶液發生顯色反應,其核磁共振氫譜有4個峰。

請回答:
(1)B的名稱為________,G中含有的官能團名稱為________。
(2)B→C、D→E的反應類型分別為______________、 。
(3)A+E→F的化學方程式為 。
(4)D發生銀鏡反應的化學方程式為 。
(5)符合下列條件的E的同分異構體有________種(不考慮立體異構),寫出其中一種的結構簡式 。
( ①含有![]() 結構 ②苯環上有2個取代基 )
結構 ②苯環上有2個取代基 )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】核電荷數由小到大順序排列的五種短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金屬性最強,Q的非金屬性最強;W的單質是淡黃色固體;X、Y、W在周期表中的相對位置關系如圖所示
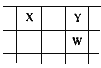
(1)五種元素形成的單質,其中固態時屬于原子晶體的是________(填化學式);常用作強氧化劑的是________、________(填化學式)。
(2)這五種元素中,原子半徑最大的是________(填化學式);由Z、W、Q形成的簡單離子半徑由大到小的順序是________(用化學式表示);X、W、Q的最高價氧化物的水化物酸性從強到弱的順序是________(用化學式表示)。
(3)Y和Z形成的一種化合物中含有離子鍵和共價鍵,請用電子書表示該化合物中化學鍵的形成過程___________________________________。
(4)Z與Q反應生成的化合物屬于________化合物;電解該化合物的飽和溶液,陽極的電極反應式為________;電解一段時間后,將陽極產物和陰極溶液混合,反應的化學方程式是______________。
(5)由X、Y和氫三種元素組成的化合物X6H12Y6,已知:9 g該化合物燃燒放出140 kJ的熱,寫出該化合物燃燒熱的熱化學方程式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在具有下列電子排布式的原子中,原子半徑最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某汽車安全氣囊的產氣藥劑主要含有NaN3、Fe2O3、KClO4、NaHCO3等物質。當汽車發生碰撞時,產氣藥劑產生大量氣體使氣囊迅速膨脹,從而起到保護作用。
(1)Fe2O3是主氧化劑,與Na發生置換反應生成的還原產物為________(填化學式)。
(2)KClO4是助氧化劑,其中含有化學鍵的類型為________________________。
(3)NaHCO3是冷卻劑,吸收產氣過程中釋放的熱量而發生分解,其化學方程式為
________________________________________________________________。
(4)NaN3是氣體發生劑,受熱分解產生N2和Na。取56 g上述產氣藥劑,分解產生的氣體通過堿石灰后的體積為16.8 L(標準狀況),該產氣藥劑中NaN3的質量分數為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com