
【題目】下圖是一個化學過程的示意圖。
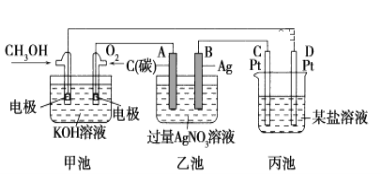
(1)圖中甲池是________裝置(填“電解池”或“原電池”)
(2)寫出通入CH3OH的電極的電極反應式: _______________________。
(3)向乙池兩電極附近分別滴加適量紫色石蕊試液,附近變紅的電極為________極(填“A”或“B”),并寫出此電極的電極反應式:______________。
(4)若丙中電極不變,將其溶液換成NaCl溶液,丙池中總反應的離子方程式:__________。
(5)常溫下,當乙池中B(Ag)極的質量增加5.40 g時,乙池的pH是________(若此時乙池中溶液的體積為500 mL);
【答案】原電池 CH3OH-6e-+8OH-===CO32-+6H2O A 4OH--4e-=O2↑+2H2O 2Cl-+2H2O![]() Cl2+H2↑+2OH- 1
Cl2+H2↑+2OH- 1
【解析】
根據甲池能自發進行氧化還原反應,結合燃料電池的工作原理;通入甲醇的電極為負極、通入氧氣的電極為正極,電解池中連接原電池負極的電極為陰極、連接原電池正極的電極為陽極;乙池有外接電源是電解池,陽極上氫氧根離子失電子生成氧氣和水,陰極上銀離子得電子,酸性溶液使紫色石蕊試液變紅;根據銀和氫離子關系式計算氫離子濃度,從而確定溶液的pH。
(1)圖中甲池能自發進行氧化還原反應,將化學能轉化為電能,所以屬于原電池,故答案為原電池。
(2)甲醇失電子和氫氧根離子反應生成碳酸根離子和水,電極反應式為:CH3OH-6e-+8OH-=CO32-+6H2O;故答案為CH3OH-6e-+8OH-=CO32-+6H2O。
(3)乙池有外接電源屬于電解池,連接原電池正極的A是陽極,連接原電池負極的B是陰極,電解硝酸銀溶液時,A電極上氫氧根離子失電子生成氧氣和水,溶液呈酸性,加入紫色石蕊試液呈紅色,電極反應式為:4OH--4e-=O2↑+2H2O;故答案為A ;4OH--4e-=O2↑+2H2O。(4)用Pt電極電解氯化鈉溶液時,氫離子得電子生成氫氣、氯離子失電子生成氯氣,總反應的離子方程式為:2Cl-+2H2O![]() Cl2+H2↑+2OH-,故答案為2Cl-+2H2O
Cl2+H2↑+2OH-,故答案為2Cl-+2H2O![]() Cl2+H2↑+2OH-。
Cl2+H2↑+2OH-。
(5)乙池中的總反應為:4Ag++2H2O![]() 4Ag+O2↑+4H+,當乙池中B(Ag)極的質量增加5.40g時,設氫離子濃度為xmol/L,則
4Ag+O2↑+4H+,當乙池中B(Ag)極的質量增加5.40g時,設氫離子濃度為xmol/L,則
4Ag++2H2O![]() 4Ag↓+O2↑+4H+
4Ag↓+O2↑+4H+
432g 4mol
5.40g 0.5xmol
![]()
解得x=0.1mol/L,則溶液的pH=1,故答案為1。


科目:高中化學 來源: 題型:
【題目】25℃時,Fe(OH)2和Cu(OH)2的飽和溶液中,金屬陽離子的物質的量濃度的負對數[一lg c(M2+)]與溶液pH的變化關系如圖所示,已知該溫度下,Ksp[Cu(OH)2]2],下列說法正確的是 ( )

A. b線表示Fe(OH)2飽和溶液中的變化關系,且Ksp[Fe(OH)2]=10-15.1
B. 當Fe(OH)2和Cu(OH)2沉淀共存時,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X點對應的飽和溶液中加入少量NaOH,可轉化為Y點對應的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入適量Cu0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2的回收與利用是科學家研究的熱點課題。可利用CH4與CO2制備合成氣(CO、H2),還可制備甲醇、二甲醚、低碳烯經等燃料產品。
I.科學家提出制備“合成氣”反應歷程分兩步:
反應①:CH4(g)C(ads) +2H2(g) (慢反應)
反應②:C(ads) + CO2(g)2CO(g) (快反應)
上述反應中C(ads)為吸附性活性炭,反應歷程的能量變化如圖:
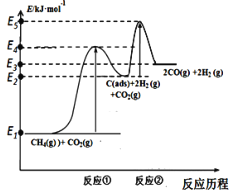
(1)CH4與CO2制備合成氣的熱化學方程式為____________:該反應在高溫下可自發正向進行的原因是_________,能量變化圖中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成氣”合成申醇后,脫水制得二甲醚。
反應為:2CH3OH(g)CH3OCH3 (g) + H2O(g) △H
經查閱資料,在一定范圍內,上述反應化學平衡常數與熱力學溫度存在如下關系:lnKc=-2.205+![]() 。其速率方程為:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆為速率常數,且影響外因只有溫度。
。其速率方程為:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆為速率常數,且影響外因只有溫度。
(2)反應達到平衡后,僅升高溫度,k正增大的倍數________ k逆增大的倍數(填“>”、“<”或“= ”)。
(3)某溫度下,Kc=200,在密閉容器中加入一定量CH3OH。反應到某時刻測得各組分的物質的量如下:
物質 | CH3OH | CH3OCH3 | H2O |
物質的量/mol | 0.4 | 0.4 | 0.4 |
此時正、逆反應速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密閉容器中加入一定量甲醇CH3OH,反應到達平衡狀態時,體系中CH3OCH3(g)的物質的量分數為_____(埴標號)
A.![]() B.
B.![]() C.
C.![]() D.無法確定
D.無法確定
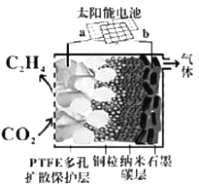
Ⅲ.合成低碳烯經
(5)強堿性電催化還原CO2制備乙烯研究取得突破進展,原理如圖所示。b極接的是太陽能電池的_______極(已知PTFE浸泡了飽和KCl溶液)。請寫出陰極的電極反應式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻是一種銀白色的金屬,常用于金屬加工、電鍍等。工業以鉻鐵礦[主要成分是Fe(CrO2)2]為原料冶煉鉻及獲得強氧化劑Na2Cr2O7。其工藝流程如圖所示:

已知:高溫氧化時發生反應Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列問題:
(1)將鉻鐵礦的主要成分Fe(CrO2)2寫成氧化物的形式:__,高溫氧化時可以提高反應速率的方法為___(寫出一條即可)。
(2)Na2CrO4加入硫酸酸化的離子方程式為__;在實驗室中,操作a所用到的玻璃儀器有__。
(3)Na2CrO4中鉻元素化合價為__;生成1molNa2CrO4時共轉移電子的物質的量為__mol。
(4)根據有關國家標準,含CrO42-的廢水要經化學處理,使其濃度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性鋇鹽生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸處理多余的Ba2+的方法處理廢水,加入可溶性鋇鹽后,廢水中Ba2+的濃度應大于__mol·L-1,廢水處理后達到國家標準才能排放。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明礬[KA1(SO4)2·12H2O]是一種復鹽,在造紙等方面應用廣泛。采用廢易拉罐制備明礬的過程如下圖所示。
下列敘述錯誤的是
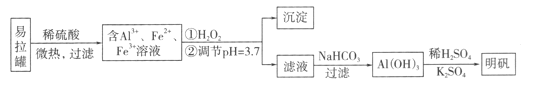
A. 合理處理易拉罐有利于環境保護和資源再利用
B. 從易拉罐中可回收的金屬元素有Al、Fe
C. “沉淀”反應的金屬離子為Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知溶解度也可用物質的量濃度表示,25℃時,Ag2CrO4在不同濃度CrO42-溶液中的溶解度如圖所示,下列說法正確的是

A.圖中a、b兩點c(Ag+)相同
B.圖中a點與b點Ag2CrO4溶度積相等
C.在a點向溶液中加入少量AgNO3,溶解度可變為c點
D.該溫度下,Ag2CrO4溶度積的數量級為10-12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素a、b、c、d的原子序數依次增大。其中A為d元素組成的非金屬單質;甲、乙、丙、丁、戊為上述四種元素組成的二元或三元化合物,常溫下乙為液體。下列說法正確的是( )

A.簡單離子半徑:c>b
B.反應①為吸熱反應
C.②反應中氧化劑與還原劑物質的量之比為1:1
D.b、d分別與a形成的化合物中,化學鍵類型一定完全相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物是大氣主要污染物,主要來自于工業廢氣及汽車尾氣的排放,工業廢氣中NO是主要成分之一。
(1)乙烯作為還原劑的脫硝(NO),其反應機理示意圖如圖所示.寫出解吸過程的化學方程式____________________。

(2)FeSO4-Na2SO3復合吸收劑吸收煙氣中的NO,該方法利用Fe2+易與NO發生絡合反應的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如圖是一段時間內不同吸收劑對NO脫除率對比,加入Na2SO3溶液后,吸收效率增強,除了Na2SO3也能吸收部分NO外,還能防氧化從而增大Fe2+的含量,寫出此原理的離子方程式_______________________________________。

②模擬實驗表明,溫度過高或過低都會降低NO的脫除率,其原因是_______________________________________。
(3)采用無隔膜法電解食鹽水脫氮可將氮氧化物轉化成NO3-,原理如圖

①無隔膜條件下電解食鹽水后溶液呈弱堿性,原因是____________________________.
②寫出NO發生反應的離子方程式____________________________。
③根據下圖所示,脫NO過程中控制溶液pH在______________范圍內更合理。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com