
| A. | 甲烷的燃燒熱為890.3kJ•mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 已知強酸與強堿在稀溶液里反應的中和熱為57.3 kJ•mol-1,則 $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化劑}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 已知25℃、101KPa條件下:4Al(s)+3O2(g)═2A12O3(s)△H=-2834.9 kJ•mol-1,4Al(s)+2O3(g)═2A12O3(s)△H=-3119.1 kJ•mol-1,則O2比O3穩定 |
分析 A.甲烷燃燒的熱化學方程式中,水的狀態必須為液態;
B.該反應中除了生成水,還生成了硫酸鋇沉淀,該放出熱量增大,焓變值減小;
C.該反應為可逆反應,放熱19.3kJ時消耗氮氣的物質的量小于0.5mol;
D.先根據蓋斯定律寫出氧氣轉化成臭氧的熱化學方程式,然后根據物質具有能量越高,物質的穩定性越差判斷.
解答 解:A.甲烷的燃燒熱為890.3kJ•mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,故A錯誤;
B.已知強酸與強堿在稀溶液里反應的中和熱為57.3 kJ•mol-1,由于鋇離子與硫酸根離子生成硫酸鋇的反應為放熱反應,則則 $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H<-57.3 kJ•mol-1,故B錯誤;
C.500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,由于該反應為可逆反應,則平衡時消耗氮氣的物質的量小于0.5mol,即1mol氮氣與氫氣完全反應放出熱量大于38.6kJ,則正確的熱化學方程式為:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化劑}$ 2NH3(g)△H<-38.6kJ•mol-1,故C錯誤;
D.①4Al(s)+302(g)=2A12O3,△H=-2834.9kJ•mol-1②4Al(s)+203(g)=2A12O3,△H=-3119.1gkJ•mol-1,根據蓋斯定律①-②可得:302(g)=203(g)△H=-2834.9kJ•mol-1-(-3119.1kJ•mol-1)=+284.2kJ•mol-1,該反應為吸熱反應,說明氧氣的能量小于臭氧,則氧氣比臭氧穩定,故D正確;
故選D.
點評 本題考查了熱化學方程式及應用,題目難度不大,明確化學反應與能力變化的關系為解答關鍵,注意掌握熱化學方程式的書寫原則,D為易錯點,注意物質穩定性與物質具有能量的關系.


 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:高中化學 來源: 題型:多選題
| A. | 降低溫度可以縮短反應達到平衡的時間 | |
| B. | 恒容時通入氬氣,壓強增大,平衡向右移動 | |
| C. | 恒容時通入X2,平衡向正反應方向移動,平衡常數不變 | |
| D. | 恒溫恒壓下,若混合氣體密度不變,說明反應已達平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗步驟 | 實驗現象 |
| ①將鎂條用砂紙打磨后,放入試管中,加入少量水后,加熱至水沸騰;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四處游動,發出“嘶嘶”聲,隨之消失,溶液變成紅色 |
| ②向新制得的Na2S溶液中滿加新制的氯水 | B.有氣體產生,溶液變成淺紅色 |
| ③將一小塊金屬鈉放入滴有酚酞溶液的冷水中 | C.劇烈反應,迅速產生大量無色氣體 |
| ④將鎂條投入稀鹽酸中 | D.反應不十分劇烈;產生無色氣體 |
| ⑤將鋁條投入稀鹽酸中 | E.生成白色膠狀沉淀,繼而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至過量 | F.生成淡黃色沉淀 |
| 實驗內容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 實驗現象(填A~F) | F | E |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N2的生成速率與NH3的分解速率相等 | |
| B. | 單位時間內生成nmolN2的同時生成3nmolH2 | |
| C. | N2、H2、NH3的濃度不再發生變化 | |
| D. | N2、H2、NH3的物質的量之比為1:3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
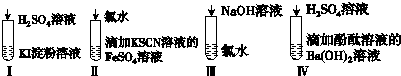
| 選項 | 現象 | 離子方程式 |
| A | I在空氣中放置一段時間后,溶液呈藍色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由淺綠色變為紅色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 顏色無變化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由紅色變無色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ClO3- | B. | MnO4- | C. | Cl2 | D. | Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 編 號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 溶液開始變藍時間(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1雙氧水 | 0.1mol•L-1稀鹽酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 無 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
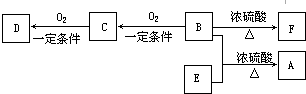
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com