
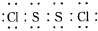 ,它不穩定,在水中易發生岐化反應(一部分硫元素價態升高,一部分降低).反應涉及的幾種物質的熔沸點如表:
,它不穩定,在水中易發生岐化反應(一部分硫元素價態升高,一部分降低).反應涉及的幾種物質的熔沸點如表:| 物質 | S | CS2 | CCl4 | S2Cl2 |
| 沸點/℃ | 445 | 47 | 77 | 137 |
| 熔點/℃ | 113 | -109 | -23 | -77 |
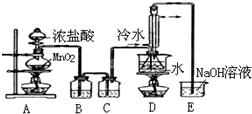
分析 制備S2Cl2原理是:在裝置A中二氧化錳和濃鹽酸之間反應得到氯氣,但是氯氣中混油HCl和水,應該先用飽和食鹽水除去HCl(裝置B),再用濃硫酸干燥氯氣(裝置C),讓氯氣和二硫化碳在一定溫度下發生反應(裝置D):2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2,為了使CS2平穩汽化,避免產物S2Cl2汽化,采用熱水浴加熱的方法,根據S2Cl2的熔沸點數據,采用冷凝回流的辦法將之收集即可試驗中的氯氣要進行尾氣處理,可以用氫氧化鈉來吸收.
(1)二氧化錳和濃鹽酸加熱反應生成氯氣、水和氯化錳;
(2)二氧化錳和稀鹽酸不反應;
(3)根據物質的制備實驗結合裝置的性質來回答;
(4)氯氣中的HCl以及水雜質應該除去,根據表中物質的沸點高低可以進行物質的分離;
(5)實驗中的處理方案以及實驗結束的安全措施要引起注意;
(6)根據題干信息:S2Cl2在水中易發生岐化反應來書寫反應方程式,在酸性環境下,氯離子和次氯酸根離子之間可以發生歸中反應得到氯氣.
解答 解:(1)用固液加熱的方法制Cl2,常用濃鹽酸和二氧化錳反應制取,反應離子方程式為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)實驗中鹽酸通常采用36.5%的濃溶液,不用稀鹽酸,因為稀鹽酸還原性弱,反應困難,故答案為:稀鹽酸還原性弱,反應困難;
(3)D中冷凝管起到導氣和冷凝回流雙重作用,此作用在制取乙酸乙酯和溴苯、石油分餾的試驗中用得到,故答案為:ACD;
(4)制取氯氣時,其中的HCl雜質應該用飽和食鹽水除去,根據表中物質的沸點高低,為了使CS2平穩汽化,避免產物S2Cl2汽化,可以采用水浴加熱的方法,結束后從錐形瓶內混合物中分離出S2Cl2的方法是蒸餾,控制溫度在137℃,
故答案為:飽和食鹽水;蒸餾;使CS2平穩汽化,避免產物S2Cl2汽化;
(5)A裝置儀器裝配時,整套裝置裝配完畢后,應先進行氣密性的檢查,再添加試劑.實驗完畢,拆除裝置時,為防止倒吸,應先將E中長導管移開液面,
故答案為:氣密性檢查;防止倒吸;
(6)S2Cl2與水反應,有無色刺激性氣味氣體產生,并有黃色沉淀生成,無色刺激性氣味氣體除氯化氫外,依據氧化還原反應的元素化合價變化守恒推斷,化合價降低的生成黃色沉淀為單質硫,化合價升高的生成二氧化硫氣體,依據原子守恒、電子守恒寫出化學方程式為:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,吸收了氯氣的氫氧化鈉溶液中含有氯化鈉、次氯酸鈉,向其中加入濃鹽酸,則在酸性環境下,氯離子和次氯酸根離子之間可以發生歸中反應得到氯氣,反應為:ClO-+2H++Cl-=Cl2↑+H2O,
故答案為:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;ClO-+2H++Cl-=Cl2↑+H2O.
點評 本題考查物質的制備,為高考常見題型,題目涉及混合物分離的方法判斷,雜質氣體除雜的裝置選擇和試劑選擇,題干信息的應用分析,離子方程式書寫,關鍵是掌握整個制備流程原理,分析流程中各裝置的作用.要求學生要有扎實的實驗基礎知識和靈活應用信息解決問題的能力,題目難度中等.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 步驟①中加酸,將溶液的pH 調節至2,溶液顯黃色,CrO42-離子濃度增大 | |
| B. | 步驟①中當溶液呈現深黃色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)時,說明反應2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O 達到平衡狀態 | |
| C. | 步驟②中,若要還原1 mol Cr2O${\;}_{7}^{2-}$離子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步驟③中,當將溶液的pH 調節至4 時,可認為廢水中的鉻元素已基本除盡 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
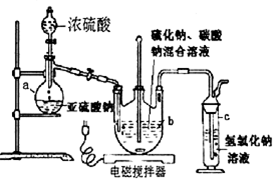
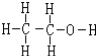 .
.| 實驗序號 | 1 | 2 | 3 |
| Na2S2O3溶液體積(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
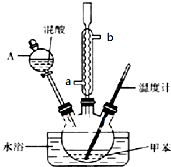 某實驗小組用下圖所示的裝置制備一硝基甲苯(含鄰硝基甲苯和對硝基甲苯):
某實驗小組用下圖所示的裝置制備一硝基甲苯(含鄰硝基甲苯和對硝基甲苯):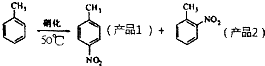
| 密度g•cm-3 | 沸點/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 產品1 | 1.286 | 237.7 | 不溶于水,易溶于液體烴 |
| 產品2 | 1.162 | 222 | 不溶于水,易溶于液體烴 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量固體樣品于試管中,加入蒸餾水至固體溶解. | 得到無色溶液 |
| 步驟2:向試管中加入過量的BaCl2溶液,靜置. | 溶液變渾濁,則證明固體中含有(NH4)2CO3. |
| 步驟3:取步驟2的上層清液于試管中加入少量的Ba(OH)2溶液. | 溶液不變渾濁,則證明固體中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
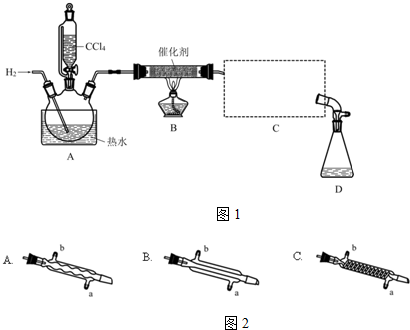
| 物質 | 相對分子質量 | 密度/(g•mL-1) | 沸點/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 難溶 |
| CCl4 | 154 | 1.59 | 76.7 | 難溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| H2C2O4 | 無色晶體 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶體 | 微溶于水,pH=7.2,不溶于乙醇 |
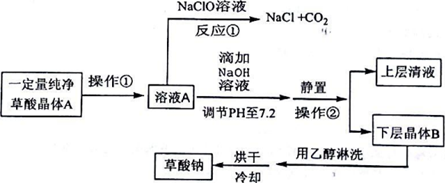
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
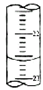 某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:①堿式滴定管用蒸餾水洗凈后,用待測溶液潤洗后,再注入待測溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0“刻度以下的位置,記下讀數;將錐形瓶用蒸餾水洗凈后,用待測溶液潤洗錐形瓶2~3次;從堿式滴定管中放入25.00mL待測溶液到錐形瓶中;②將酸式滴定管用蒸餾水洗凈后,立即向其中注入0.1000mol/L標準鹽酸,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0“刻度以下的位置,記下讀數;
某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:①堿式滴定管用蒸餾水洗凈后,用待測溶液潤洗后,再注入待測溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0“刻度以下的位置,記下讀數;將錐形瓶用蒸餾水洗凈后,用待測溶液潤洗錐形瓶2~3次;從堿式滴定管中放入25.00mL待測溶液到錐形瓶中;②將酸式滴定管用蒸餾水洗凈后,立即向其中注入0.1000mol/L標準鹽酸,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0“刻度以下的位置,記下讀數;| 滴定次數 | 待測液體(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀(mL) | 滴定后讀數(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com