
【題目】羰基硫(COS)常用作糧食熏蒸劑,制取反應為 CO(g)+H2S(g) ![]() COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密閉容器中不同條件下發生反應并達到平衡,數據如下表。
COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密閉容器中不同條件下發生反應并達到平衡,數據如下表。
實驗 | 溫度/℃ | n起始/mol | 平衡時 | 所需時間 | |||
CO | H2S | COS | H2 | n(CO)/mol | min | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 | e |
2 | 150 | 7.0 | 7.0 | 3.0 | 3.0 | a | f |
3 | 200 | 20.0 | 20.0 | 0 | 0 | 16.0 | g |
下列說法錯誤的是
A. 實驗1 反應開始到平衡整個過程中放出的熱量為 90kJ
B. 實驗2 達平衡時,a>7.0
C. 實驗3 時間:g<e
D. 實驗3 CO 達到平衡時的轉化率比實驗1 小
 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:
【題目】綠色化學的核心就是利用化學原理從源頭上減少或消除工業生產對環境的污染。下列屬于綠色化學的是
A. 氫能源代替化石能源 B. 污水的治理
C. 廢棄塑料的回收和利用 D. 焚燒“白色污染”物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廠排出的廢液主要含有硝酸鋅和硝酸銀,為了從中回收金屬銀和硝酸鋅,某中學化學課外活動小組設計了以下的實驗步驟:

(1)X是____________,Y是____________ (寫化學式,下同)。
(2)固體A、濾液B、C的主要成分:A______________,B______________,C______________。
(3)Z處進行的操作是__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】資料顯示“O2 的氧化性隨溶液pH的增大逐漸減弱”。某興趣小組探究不同條件下KI與O2的反應。實驗如下:
裝置 | 燒杯中的液體 | 現象(5分鐘后) |
| ①2mL1mol/LKI溶液+5滴淀粉 | 無明顯變化 |
②2mL1mol/LKI 溶液+5滴淀粉+1mL0.1mol/L HCl | 溶液變藍 | |
③2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol/L KCl | 無明顯變化 | |
④2mL1mol/LKI溶液+5滴淀粉+1mL0.1mol/L CH3COOH | 溶液變藍,顏色較②淺 |
下列說法不正確的是
A. 通過小燒杯中溶液顏色的變化證明反應的發生
B. ③是驗證Cl-是否影響KI與O2的反應
C. ④說明CH3COOH 是弱酸,因為和鹽酸同濃度同溫度的情況下,電離出 c(H+)濃度低
D. 此實驗還可以增加2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol·L-1NaOH 溶液這一步驟
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種消毒、殺菌效率高、二次污染小的水處理劑。實驗室可通過以下反應制得:(已知H2C2O4中的碳為+3價)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。試回答下列問題。
(1)該反應中氧化產物的化學式是___________;被還原的元素是___________。
(2)用雙線橋標出上述反應的電子轉移情況______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反應共產生了4.48L氣體(標準狀況),則反應轉移電子的物質的量為_________mol,消耗還原劑的物質的量為___________mol。
(4)標準狀況下44.8mL的ClO2氣體恰好能與50mL 0.1mol·L-1的Na2SO3溶液液完全反應,生成Na2SO4,氯元素在產物中的化合價為___________;此過程說明ClO2具有____(填“氧化”或“還原”)性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設計如下實驗探究某礦石(僅含四種短周期元素)的組成和性質,已知礦石含有一定的結晶水:
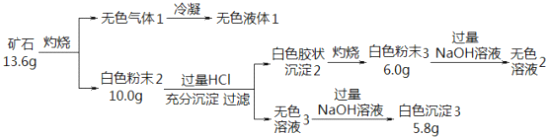
(1)礦石的組成元素是 H、O 和_____、 ______(填元素符號),化學式為_____________。
(2)白色粉末3 溶于NaOH溶液的離子方程式是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,兩圓圈相交的部分表示圓圈內的物質相互發生的反應。已知鈉及其氧化物的物質的量均為0.1 mol,水的質量為100 g。下列說法正確的是( )
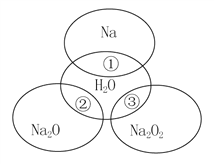
A. Na2O2中陰陽離子數目之比為1∶1
B. 反應①的離子方程式為Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反應后所得溶液中溶質的質量分數:①>②>③
D. 反應③轉移電子的物質的量為0.1mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com