
【題目】醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如圖所示.可能用到的有關數據如下:
相對分子質量 | 密度/(gcm﹣3) | 沸點/℃ | 溶解性 | |
環乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
環己烯 | 82 | 0.8102 | 83 | 難溶于水 |
a中加入20g環己醇和2小片碎瓷片,冷卻攪動下慢慢加入1mL濃硫酸.b中通入冷卻水后,開始緩慢加熱a,控制餾出物的溫度不超過90℃.反應粗產物倒入f中分別用少量5%碳酸鈉溶液和水洗滌,分離后加入無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣.最終通過蒸餾得到純凈環己烯.
回答下列問題:
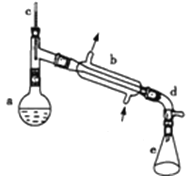
(1)由環己醇制取環己烯的反應類型為_________;
(2)裝置b的冷凝水方向是______(填下進上出或上進下出);
(3)加入碎瓷片的作用是______;如果加熱一段時間后發現忘記加瓷片,應該采取的正確操作是___(填正確答案標號).
A.立即補加 B.冷卻后補加 C.不需補加 D.重新配料
(4)本實驗中最容易產生的副產物所含的官能團名稱為____.
(5)在分離提純中,使用到的儀器f名稱是_____,分離氯化鈣的操作是_____.
(6)合成過程中加入濃硫酸的作用是_____.
【答案】消去反應 下進上出 防止暴沸 B 醚鍵 分液漏斗 過濾 催化劑、脫水劑
【解析】
(1)環己醇生成環己烯,是有機物脫去小分子生成分子中含有雙鍵的不飽和有機物;(2)冷凝水下進上出,可以提高冷凝效果;(3)碎瓷片的存在可以防止在加熱過程中產生暴沸現象;補加碎瓷片時需要待已加熱的試液冷卻后再加入;(4)加熱過程中,環己醇除可發生消去反應生成環己烯外,還可以發生分子間脫水反應生成二環己醚;(5)環己烯難溶于水,反應粗產物倒入f中分別用少量5%碳酸鈉溶液和水洗滌,環己烯與水分層,用分液法分離提純;氯化鈣是固體,固液分離用過濾法;(6)環己醇在濃硫酸催化作用下脫水生成環己烯;
(1)環己醇生成環己烯,是有機物脫去小分子生成分子中含有雙鍵的不飽和有機物,屬于消去反應;(2)冷凝水下進上出,可以提高冷凝效果,所以裝置b的冷凝水方向是下進上出;(3)碎瓷片的存在可以防止在加熱過程中產生暴沸現象,所以加入碎瓷片的作用是防止暴沸,補加碎瓷片時需要待已加熱的試液冷卻后再加入,故選B;(4)加熱過程中,環己醇除可發生消去反應生成環己烯外,還可以發生分子間脫水反應生成二環己醚,所以副產物所含的官能團名稱為醚鍵;(5)環己烯難溶于水,反應粗產物倒入f中分別用少量5%碳酸鈉溶液和水洗滌,環己烯與水分層,用分液法分離提純,所以裝置f是分液漏斗;氯化鈣是固體,固液分離用過濾法;(6)環己醇在濃硫酸催化作用下脫水生成環己烯,濃硫酸的作用是催化劑、脫水劑。


 快樂小博士鞏固與提高系列答案
快樂小博士鞏固與提高系列答案科目:高中化學 來源: 題型:
【題目】在密閉容器中,一定條件下進行反應:mA(氣)+nB (氣)![]() pC(氣)+qD(氣),若增大壓強,或升高溫度,重新達到平衡,
pC(氣)+qD(氣),若增大壓強,或升高溫度,重新達到平衡,![]() 隨時間化過程均如圖所示,則對該反應敘述正確的是
隨時間化過程均如圖所示,則對該反應敘述正確的是

A. 正反應是放熱反應, m+n<p+q
B. 逆反應是放熱反應, m+n﹥p+q
C. 正反應是放熱反應, m+n﹥p+q
D. 逆反應是放熱反應, m+n﹥p+q
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物對環境具有顯著影響。
(1)已知汽車氣缸中氮及其化合物發生如下反應:
![]() △H=+180 kJ·mol-1
△H=+180 kJ·mol-1
![]() △H=+68 kJ·mol-1
△H=+68 kJ·mol-1
則![]() △H=__________ kJ·mol-1
△H=__________ kJ·mol-1
(2)對于反應![]() 的反應歷程如下:
的反應歷程如下:
第一步:
第二步:![]()
其中可近似認為第二步反應不影響第一步的平衡,第一步反應中:υ正=k1正·c2(NO),υ逆=k1逆·c(N2O2),k1正、k1逆為速率常數,僅受溫度影響。下列敘述正確的是______(填標號)
A 整個反應的速率由第一步反應速率決定
B 同一溫度下,平衡時第一步反應的k1正/k1逆越大,反應正向程度越大
C 第二步反應速率低,因而轉化率也低
D 第二步反應的活化能比第一步反應的活化能高
(3)科學家研究出了一種高效催化劑,可以將CO和NO2兩者轉化為無污染氣體,反應方程式為:![]() △H<0。某溫度下,向10 L密閉容器中分別充入0.1 mol NO2和0.2 mol CO,發生上述反應,隨著反應的進行,容器內的壓強變化如下表所示:
△H<0。某溫度下,向10 L密閉容器中分別充入0.1 mol NO2和0.2 mol CO,發生上述反應,隨著反應的進行,容器內的壓強變化如下表所示:
時間/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
壓強/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
在此溫度下,反應的平衡常數Kp=___________kPa-1(K
(4)汽車排氣管裝有的三元催化裝置,可以消除CO、NO等的污染,反應機理如下
I: NO+Pt(s)=NO(*) [Pt(s)表示催化劑,NO(*)表示吸附態NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
III:NO(*)=N(*)+O(*)
IV:CO(*)+O(*)=CO2+2Pt(s)
V:N(*)+N(*)=N2+2 Pt(s)
VI:NO(*)+N(*)=N2O+2 Pt(s)
尾氣中反應物及生成物濃度隨溫度的變化關系如圖。

①330℃以下的低溫區發生的主要反應的化學方程式是__________________________。
②反應V的活化能_____反應VI的活化能(填“<”、“>”或“=”),理由是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微生物燃料電池是指在微生物的作用下將化學能轉化為電能的裝置。某微生物燃料電池的工作原理如圖所示,下列說法正確的是

A. 電子從b流出,經外電路流向a
B. HS-在硫氧化菌作用下轉化為SO42-的反應是HS-+4H2O-8e-=SO42-+9H+
C. 如果將反應物直接燃燒,能量的利用率不會變化
D. 若該電池電路中有0.4mol電子發生轉移,則有0.5molH+通過質子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求寫出下列反應方程式(請注明反應條件),并按要求填空
(1)實驗室制備乙烯_______________,反應類型是___________.
(2)乙酸與乙醇的反應______________,反應的無機產物中氧元素的來源是________。
(3)溴乙烷與氫氧化鈉水溶液共熱_____________,此反應將鹵代烴類物質轉化為______類物質.
(4)苯與濃硫酸、濃硝酸的混合酸在加熱時發生反應__________,反應類型是___________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A、B、C、D、E之間發生如下的轉化:
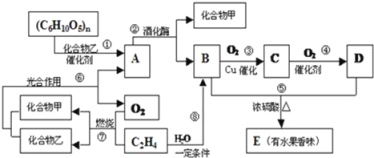
(1)寫出D分子中官能團的名稱:_____,C物質的結構簡式:____.
(2)向A的水溶液中加入新制的Cu(OH)2并加熱時產生的實驗現象是__________.
(3)請寫出下列轉化的化學反應方程式:
①(C6H10O5)n→A:_____; ②乙烯生成聚乙烯:_____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為原子序數依次增大的短周期主族元素,其原子半徑與最外層電子數的關系如下圖1。E原子最外層上的電子數是D原子最外層電子數的4倍,D離子核外電子排布與C2-相同。

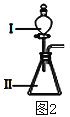
試回答:
(1)元素E在元素周期表中的位置是___________________。
(2)與元素D離子所含電子數和質子數均相同的微粒是________________。(用化學式作答,下同)
(3)B和E最高價氧化物對應的水化物,酸性較弱的_________________。若用上圖2中裝置驗證這兩種酸的酸性強弱,則在裝置中加入的試劑分別為:Ⅰ___________,Ⅱ__________,觀察到的實驗現象是________________________。
(4)由以上五種元素組成的物質,其組成和結構信息如下表:
物質 | 組成和結構信息 |
a | 含有A、C、D的鹽 |
b | C、D組成的化合物,且原子數之比為1∶1 |
c | 化學組成為AC2 |
①a含有的化學鍵有___________________________________;
②b與c反應的化學方程式為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉系統中有反應C(s)+CO2(g) ![]() 2CO(g),能使反應速率加快的措施是
2CO(g),能使反應速率加快的措施是
①通過減小容器體積增大壓強 ②升高溫度 ③將炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容條件下通入N2使得壓強增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以碳酸鎂(含少量FeCO3)為原料制取硫酸鎂晶體,并測定Mg2+含量:將原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水調節溶液的pH,靜置后過濾,除去濾渣,將濾液結晶得硫酸鎂晶體。
(1)30.00mL 5.00 mol·L1的稀硫酸至少能溶解原料的質量為___________。
(2)加氨水調節pH促進Fe3+水解,Fe3+水解離子方程式為___________。
(3)已知:Ksp[Fe(OH)3]=1.0×1039,Ksp[Mg(OH)2]=1.0×1012。室溫下,若溶液中c(Mg2+)=0.01mol·L1,欲使溶液中的c(Fe3+)≤1×106mol·L1,需調節溶液pH范圍為___________。
(4)常采用下列方法測定結晶硫酸鎂中Mg2+的含量:
已知:①在pH為9~10時,Mg2+、Zn2+均能與EDTA(H2Y2)形成配合物
②在pH為5~6時,Zn2+除了與EDTA反應,還能將Mg2+與EDTA形成的配合物中的Mg2+“置換”出來: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步驟1:準確稱取得到的硫酸鎂晶體1.50g加入過量的EDTA,配成100mL pH9~10之間溶液A
步驟2:準確移取25.00mL溶液A于錐形瓶中,用0.10mol·L1Zn2+標準溶液滴定,滴定到終點,消耗Zn2+標準溶液的體積為20.00mL
步驟3:準確移取25.00mL溶液A于另一只錐形瓶中,調節pH在5~6;用0.10mol·L1Zn2+標準溶液滴定,滴定至終點,消耗Zn2+標準溶液的體積為30.00mL。
計算該結晶硫酸鎂中Mg2+的質量分數(請給出計算過程)。___________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com