
【題目】二甲醚是重要的有機中間體,利用二氧化碳加氫合成二甲醚能變廢為寶,且可替代汽油作為新型清潔燃料。常溫常壓下,二氧化碳加氫可選擇性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(l) △H3
④H2O(l)=H2O(g) △H4=+44.0kJ/mol
(1)已知反應CO2(g)+H2(g)=CO(g)+H2O(g)△H,中相關的化學鍵鍵能數據如下:

由此計算△H=______,則△H3=_______。
(2)CO2(g)加氫轉化為CH3OCH3(g)和H2O(l)的熱化學方程式是___。
(3)合成二甲醚往往選用硅鋁混合物作催化劑,硅鋁比例不同,生成二甲醚或一氧化碳的物質的量分數不同。硅鋁比與產物選擇性如圖所示,圖中A點和B點的平衡常數比較:KA___KB(填“>、=、<”)。根據以上兩條曲線,寫出其中一條變化規律:a.___。b.___。
(4)常溫常壓下,向一個2.00L的密閉恒容容器中加入等量2.00mol二氧化碳和氫氣,平衡時二甲醚的濃度為0.150mol/L,計算此時二氧化碳的轉化率及該反應的平衡常數,要求寫出計算過程(計算結果保留3位有效數字)________、_________。

【答案】﹣80kJ/mol ﹣124kJ/mol 2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l) △H=﹣134.8kJ/mol = 溫度越高,二甲醚的選擇性越大 低溫時硅鋁比對二甲醚的選擇性影響不大;高溫時隨著硅鋁比增大,二甲醚的選擇性先增大后減小 30.0% 3.06×105
【解析】
(1)反應物總鍵能減去生成物總鍵能等于該反應焓變,根據蓋斯定律將已知的熱化學方程式疊加,可得總反應方程式;
(2)根據蓋斯定律將已知的熱化學方程式疊加,△H進行相應的改變,可得總反應方程式;
(3)化學平衡常數只與溫度有關,溫度不變化學平衡常數不變;相同溫度下,根據曲線變化趨勢與硅鋁比分析;不同溫度下,硅鋁比相同時,比較其選擇性關系;
(4)根據物質反應轉化關系,計算平衡時各種物質的濃度,帶入平衡常數表達式和物質轉化率含義式,可得相應的數值。
(1)CO2(g)+H2(g)=CO(g)+H2O(g) △H=(745×2+436-1076-2×465)kJ/mol=-80kJ/mol;
i .H2O(l)=H2O(g) △H4=+44.0kJ/mol
ii. CO2(g)+H2(g)=CO(g)+H2O(g) △H
將方程式ii-i得CO2(g)+H2(g)=CO(g)+H2O(l) △H3=△H-△H4=(-80-44.0)kJ/mol=-124kJ/mol;
(2)①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
將方程式2×①+②得2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l) △H=2(-55.7kJ/mol)+(-23.4)kJ/mol=-134.8kJ/mol;
(3)化學平衡常數只與溫度有關,溫度不變化學平衡常數不變,A、B兩點溫度相同,則KA=KB,根據圖知有關變化規律,a.溫度越高,二甲醚的選擇性越大;b.低溫時硅鋁比對二甲醚的選擇性影響不大,高溫時隨著硅鋁比增大,二甲醚的選擇性先增大后減小;
(4)起始狀態c(H2)=c(CO2)= 2.00mol÷2.00L=1.00mol/L;根據題意可知反應達到平衡時c(CH3OCH3)=0.150mol/L,則根據物質轉化關系可知,c(CH3OCH3)=0.450mol/L,c(CO2)=1.00mol/L-2×0.150mol/L=0.700mol/L,c(H2)=1.00mol/L-6×0.150mol/L=0.100mol/L,所以CO2的轉化率=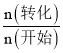 ×100%=
×100%=![]() ×100%=30.0%;化學平衡常數K=
×100%=30.0%;化學平衡常數K=![]() =3.06×105。
=3.06×105。


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:
【題目】下列反應屬于取代反應的是( )
A.CH2=CH2+Br2→CH2BrCH2Br
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.C3H8 + 5O2 ![]() 3CO2 + 4H2O
3CO2 + 4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了保護環境,充分利用資源,某研究小組通過如下簡化流程,將工業制硫酸的硫鐵礦渣(鐵主要以Fe2O3存在)轉變成重要的化工原料FeSO4(反應條件略)。
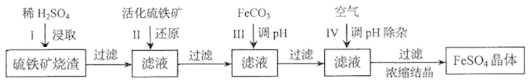
活化硫鐵礦還原Fe3+的主要反應為:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考慮其他反應。請回答下列問題:
(1)第Ⅰ步H2SO4與Fe2O3反應的離子方程式是_____________________。
(2)檢驗第Ⅱ步中Fe3+是否完全還原,應選擇_________________(填字母編號)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3調溶液pH到5.8左右,然后在第Ⅳ步通入空氣使溶液pH降到5.2,此時Fe2+不沉淀,濾液中鋁、硅雜質除盡。通入空氣引起溶液pH降低的原因是_______________。
(4)FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料。該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+ FeS2=Fe+2Li2S,正極反應式是___________。
(5)FeSO4可轉化為FeCO3,FeCO3在空氣中加熱反應可制得鐵系氧化物材料。
已知25℃,101kPa時:4Fe(s)+ 3O2 (g)=2Fe2O3(s)H=-1648kJ/mol
C(s)+O2(g)=CO2(g)H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)H =-1480kJ/mol
FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是______________。
(6)假如燒渣中的鐵全部視為Fe2O3,其含量為p。將b kg質量分數為c的硫酸加入到a kg燒渣中浸取,鐵的浸取率為q,其他雜質浸出消耗的硫酸以及調pH后溶液呈微酸性所殘留的硫酸忽略不計。按上述流程,第Ⅲ步應加入FeCO3___________kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用純凈的CaCO3與稀HCl反應制CO2,實驗過程記錄如右圖所示。根據分析、判斷,正確的是( )
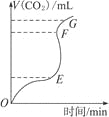
A.OE段表示的反應速率最快
B.EF段表示的反應速率最快,收集的CO2最多
C.FG段收集的CO2最多
D.OG段表示隨著時間的推移,反應速率逐漸增快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是短元素周期表的一部分,①~⑨是元素周期表中的部分元素。
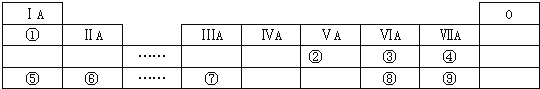
請回答下列問題:
(1)元素③④⑧的氣態氫化物中最穩定的是__________(填化學式);
(2)元素⑤和⑦的最高價氧化物對應的水化物發生反應的離子方程式是_______________;
(3)元素⑥和⑨形成的化合物的電子式是________________;
(4)③、⑤、⑥形成的簡單離子半徑由大到小的順序為_______________(寫離子符號);
(5)由表中兩種元素形成的氫化物A和B都含有18個電子,A是一種6原子分子,可做火箭發動機燃料;B是一種常見強氧化劑;已知液態A與液態B充分反應生成一種液態10電子分子和一種氣態單質,寫出A與B反應的化學方程式:___________________________;
(6)某同學為了比較元素⑧和⑨非金屬性的相對強弱,用如圖所示裝置進行實驗:
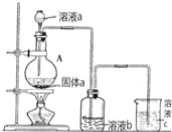
①濃溶液a和溶液b分別為_________、_______(寫化學式);
②濃溶液a與黑色固體a反應的離子方程式為_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
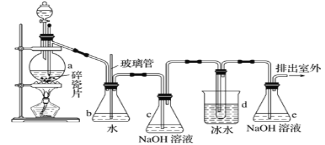
【題目】1,2-二溴乙烷可作抗爆劑的添加劑。如圖為實驗室制備1,2-二溴乙烷的裝罝圖,圖中分液漏斗和燒瓶a中分別裝有濃H2SO4和無水乙醇,d裝罝試管中裝有液溴。
相關數據列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
狀態 | 無色液體 | 無色液體 | 無色液體 | 紅棕色液體 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸點/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔點/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 難溶 | 微溶 | 可溶 |
(1)裝置a中發生主要反應的方程式為:___。為防止副反應發生,實驗中的具體操作為:___。
(2)安全瓶b在實驗中有多重作用。其一可以檢查實驗進行中d裝罝中導管是否發生堵塞,如果實驗時d裝罝中導管堵塞,你認為可能的原因:___;安全瓶b還可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某學生在做此實驗時,使用一定量的液溴,當溴全部褪色時,所消耗乙醇和濃硫酸混合液的量,比理論值超過許多,如果裝罝的氣密性沒有問題,試分析可能的原因:___、___(寫出兩條即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
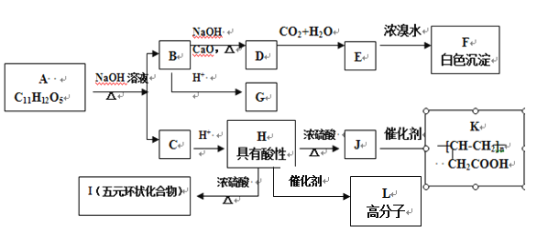
【題目】某芳香族化合物A,與碳酸鈉溶液反應生成CO2,遇FeCl3溶液顯色,A分子結構中不含甲基,苯環上的一氯代物只有兩種, A和其他有機物存在如下圖所示的轉化關系:
已知: ![]() +NaOH
+NaOH R—H + Na2CO3
R—H + Na2CO3
試回答下列問題:
(1)D化學式___。
(2)H→L反應類型為___,J所含官能團的名稱為___。
(3)寫出H→I反應的化學方程式___。
(4)A的結構簡式___。
(5)用系統命名法命名F___,F同分異構體中含有苯環且官能團相同的物質共有___種(不包括F),其中核磁共振氫譜有兩個峰,且峰面積比為1︰2的是___(寫結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、Q、R是6種短周期元素,其原子半徑及主要化合價如下:
元素代號 | X | Y | Z | M | Q | R |
原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合價 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成簡單離子,其中離子半徑最大的是__________(填離子符號)。
(3)周期表中有些處于對角線(左上→右下)位置的元素,它們的單質及其化合物的性質相似,則M的氧化物與強堿溶液反應的離子方程式______________________________。
(4)Q和R按原子個數比1:1組成的化合物甲是一種“綠色”氧化劑。
①甲中所含共價鍵類型是____________________。
②空氣陰極法電解制備甲的裝置如圖所示。在堿性溶液中,利用空氣中的氧氣還原得到甲和稀堿的溶液。圖中a是__________極,陰極的電極反應式是____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為0.1mol·L-1、體積為V0的HX、HY溶液,分別加水稀釋至體積V,pH隨lg ![]() 的變化關系如圖所示。下列敘述正確的是( )
的變化關系如圖所示。下列敘述正確的是( )

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常溫下,由水電離出的c(H+)·c(OH-):a<b
C.相同溫度下,電離常數K(HX):a>b
D.lg ![]() =3,若同時微熱兩種溶液,則
=3,若同時微熱兩種溶液,則![]() 減小
減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com