
【題目】甲酸是基本有機化工原料之一,廣泛用于農藥、皮革、染料、醫藥和橡膠等工業。
(1)工業上利用甲酸的能量關系轉換圖如圖:

反應![]() 的焓變
的焓變![]() ________
________![]() 。
。
(2)某科學小組研究不同壓強條件對反應![]() 的影響。
的影響。![]() 下,在一個容積可變的密閉容器中,充入一定量的
下,在一個容積可變的密閉容器中,充入一定量的![]() 和
和![]() ,測得不同壓強下,平衡時容器內氣體的濃度如下表:
,測得不同壓強下,平衡時容器內氣體的濃度如下表:
試驗編號 | 反應壓強 | 物質濃度 | ||
|
|
| ||
1 |
| 0.3 | 0.3 | 0.9 |
2 |
|
|
| 0.4 |
3 |
| 0.4 | 0.4 |
|
試回答以下問題:
①平衡時,實驗1的正反應速率________(填“>”、“<”或“=”)實驗3的逆反應速率。
②由實驗1的數據可計算![]() 時,該反應的平衡常數
時,該反應的平衡常數![]() ________。
________。
③![]() ________
________![]() 。
。
(3)經研究發現采用電還原法也可將![]() 轉化為甲酸根,同時還能提高
轉化為甲酸根,同時還能提高![]() 的轉換效率。其電解原理如圖所示,下列敘述正確的是________。
的轉換效率。其電解原理如圖所示,下列敘述正確的是________。
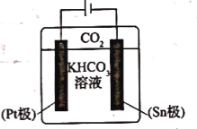
A.![]() 極的電極反應式為
極的電極反應式為![]()
B.電解過程中![]() 向
向![]() 極移動
極移動
C.![]() 極發生還原反應并有氣體逸出
極發生還原反應并有氣體逸出
D.電解過程中![]() 濃度逐漸減小
濃度逐漸減小
(4)甲酸的用途之一是用于配制“緩沖溶液”,在這種溶液中加入少量的強酸蝕堿,溶液的![]() 變化不大,能保持溶液
變化不大,能保持溶液![]() 相對穩定。(已知甲酸的電離平衡常數
相對穩定。(已知甲酸的電離平衡常數![]() )
)
①現將等濃度甲酸與甲酸鈉溶液混合,配成![]() 的
的![]() 緩沖溶液。用離子方程式表示將少量強堿加入
緩沖溶液。用離子方程式表示將少量強堿加入![]() 緩沖溶液中,
緩沖溶液中,![]() 變化不大的原因是________。
變化不大的原因是________。
②若用![]() 溶液配制
溶液配制![]() 為4的緩沖溶液,需加入________
為4的緩沖溶液,需加入________![]() (答案保留一位小數)
(答案保留一位小數)![]() 溶液。
溶液。
【答案】+31.4 < 10 0.2 AD HCOOH+OH-=HCOO-+H2O 642.9
【解析】
根據蓋斯定律,求出反應熱;根據題中數據平衡時實驗3的平衡濃度大于實驗1的平衡濃度,判斷反應速率大小;根據題中實驗1數據,計算平衡常數K值;根據溫度不變,K值不變計算實驗2中的a;根據緩沖溶液的原理解釋加入少量NaOH,酸堿中和,pH變化不大;根據緩沖溶液配制原理計算加入NaOH的體積。
(1)由圖示可知①HCOOH(g)CO (g)+H2O(g)△H=+72.6kJ/mol;②CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0kJ/mol;③H2(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol;③H2(g)+![]() O2(g)=H2O(g)△H=-241.8kJ/mol,利用蓋斯定律,將①+②-③可得HCOOH(g)CO2(g)+H2(g)的焓變△H=(+72.6kJ/mol)+(-283.0kJ/mol)-(-241.8kJ/mol)=+31.4kJ/mol;答案為+31.4。
O2(g)=H2O(g)△H=-241.8kJ/mol,利用蓋斯定律,將①+②-③可得HCOOH(g)CO2(g)+H2(g)的焓變△H=(+72.6kJ/mol)+(-283.0kJ/mol)-(-241.8kJ/mol)=+31.4kJ/mol;答案為+31.4。
(2)①實驗1、2、3均在恒溫恒壓下進行,由表中數據可知實驗3平衡濃度比實驗1的大,則壓強較大,反應速率較大,平衡時,實驗1的正反應速率小于實驗3的逆反應速率;答案為<。
②由![]() △H=-31.4 kJ/mol可知,平衡常數K=
△H=-31.4 kJ/mol可知,平衡常數K= ![]() ,代入實驗1的數據即K=
,代入實驗1的數據即K=![]() =10;答案為10。
=10;答案為10。
③反應在相同溫度下進行,平衡常數K不變,則K=10,可知K=![]() =
=![]() =10,解得a=0.2;答案為0.2。
=10,解得a=0.2;答案為0.2。
(3)A.Sn與電源負極相連,Sn極為陰極,CO2得到電子發生還原反應轉化為HCOO-,電極反應為CO2+2e-+HCO3-=HCOO-+CO32-,故A正確;
B.電解過程中陽離子向陰極移動,則K+向陰極移動,即向Sn極移動,故B錯誤;
C.Pt極為陽極,失去電子,發生氧化反應:2H2O-4e-=4H++O2↑,有O2逸出,故C錯誤;
D.根據陰極電極反應CO2+2e-+HCO3-=HCOO-+CO32-可知,電解過程中HCO3-濃度逐漸減小,故D正確;
答案為AD。
(4)①將少量強堿加入HCOOH-HCOONa緩沖溶液中,HCOOH可與NaOH反應,導致pH變化不大,離子方程式為HCOOH+OH-=HCOO-+H2O;答案為:HCOOH+OH-=HCOO-+H2O。
②若用100mL2molL-1HCOOH溶液配制pH為4即c(H+)=10-4mol/L的緩沖溶液,則由HCOOH![]() HCOO-+H+可知,Ka=
HCOO-+H+可知,Ka=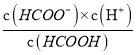 =
=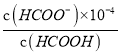 =1.8×10-4,得出c(HCOO-)=1.8c(HCOOH),原溶液中n(HCOOH)=0.2mol,設加入NaOH的物質的量為x,因為NaOH與HCOOH發生HCOOH+NaOH=HCOONa+H2O可知,n(NaOH)=n(HCOO-
=1.8×10-4,得出c(HCOO-)=1.8c(HCOOH),原溶液中n(HCOOH)=0.2mol,設加入NaOH的物質的量為x,因為NaOH與HCOOH發生HCOOH+NaOH=HCOONa+H2O可知,n(NaOH)=n(HCOO-![]() =
=![]() =0.6429L=642.9mL;答案為642.9。
=0.6429L=642.9mL;答案為642.9。


 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:高中化學 來源: 題型:
【題目】聚乳酸的結構簡式如圖 a,下列敘述錯誤的是
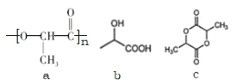
A.b 是合成聚乳酸的單體
B.1mol 乳酸與足量鈉反應,生成 2mol 氫氣
C.n mol 乳酸縮聚生成圖 a 結構,同時生成 n molH2O
D.c 屬于環酯,1molc 水解消耗 2molNaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著各地“限牌”政策的推出,電動汽車成為汽車界的“新寵”。特斯拉全電動汽車使用的是鈷酸鋰(LiCoO2)電池,其工作原理如圖所示。其中 A 極材料是金屬鋰和碳的復合材料(碳作為金屬鋰的載體),電解質為一種能傳導 Li+的高分子材料,隔膜只允特定的離子通過,電池反應式為:LixC6+Li1-xCoO2![]() C6+LiCoO2。下列說法不正確的是( )
C6+LiCoO2。下列說法不正確的是( )

A. 該隔膜只允許 Li+通過,放電時 Li+從左邊流向右邊
B. 放電時,正極鋰的化合價未發生改變
C. 充電時 B 作陽極,該電極放電時的電極反應式為 Li1-xCoO2+xLi++xe-=LiCoO2
D. 廢舊鈷酸鋰(LiCoO2)電池進行“放電處理”讓 Li+進入石墨中而有利于回收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X與Z、M都不在同一周期,Z的核電荷數是M的2倍。下列說法正確的是
A.簡單陽離子的氧化性:![]()
B.氣態氫化物的沸點:![]()
C.X、Z與M不可能存在同一離子化合物中
D.Y2Z的溶液:c(Y+):c(Z2-) > 2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:![]() ,
,![]() 。常溫下,向某濃度的鹽酸溶液中滴加氫氧化鈉溶液,所得溶液的
。常溫下,向某濃度的鹽酸溶液中滴加氫氧化鈉溶液,所得溶液的![]() 和
和![]() 變化如圖所示。下列說法正確的是( )
變化如圖所示。下列說法正確的是( )
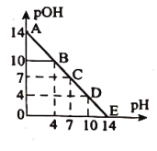
A.鹽酸與![]() 溶液的濃度相等
溶液的濃度相等
B.![]() 點和
點和![]() 點水的電離程度相同
點水的電離程度相同
C.滴加![]() 溶液改為加水稀釋,該圖曲線不變
溶液改為加水稀釋,該圖曲線不變
D.升高溫度,滴定過程中pH+pOH>14
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋資源的利用具有廣闊前景。
(1)下列不屬于海水淡化的方法________(填序號)。
A.蒸餾法 B.離子交換法
C.過濾法 D.電滲析法
(2)如圖是從海水中提取鎂的簡單流程。
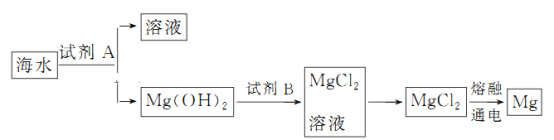
①試劑B是________(填化學式)。
②由無水MgCl2制取Mg的化學方程式是__________________________________________
(3)海帶灰中富含以I-形式存在的碘元素。實驗室提取I2的途徑如下所示:
海帶![]() 海帶灰
海帶灰![]() 海帶灰懸濁液
海帶灰懸濁液![]() 含I-溶液
含I-溶液![]() 含I2水溶液
含I2水溶液![]() 含I2苯溶液
含I2苯溶液![]() 單質I2
單質I2
Ⅰ.下列不屬于步驟①操作所用的儀器是________(填序號)。
A.酒精燈 B.漏斗
C.坩堝 D.泥三角
Ⅱ.步驟③的實驗操作名稱是________。
Ⅲ.④步驟反應的離子方程式____________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質性質的敘述錯誤的是
A. 將過量氨氣通入CuSO4溶液中可得深藍色溶液
B. 蛋白質溶于水所得分散系可產生丁達爾效應
C. 硅酸鈉溶液與稀鹽酸反應可生成硅酸膠體
D. 過量鐵粉在氯氣中燃燒可生成氯化亞鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右下表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,W元素的核電荷數為X元素的2倍。下列說法正確的是( )
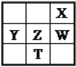
A. X、W、Z元素的原子半徑及它們的氣態氫化物的熱穩定性均依次遞增
B. Y、Z、W元素在自然界中均不能以游離態存在,它們的最高價氧化物的水化物的酸性依次遞增
C. YX2晶體熔化、液態WX3氣化均需克服分子間作用力
D. 根據元素周期律,可以推測T元素的單質具有半導體特性,T2X3具有氧化性和還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用鹽酸的質量分數為36.5%,密度為1.20 g·mL-1。
(1)此濃鹽酸中HCl的物質的量濃度是________。
(2)配制100 mL該濃鹽酸,需要標準狀況下HCl的體積為________。
(3)配制100 mL 3.00 mol·L-1的鹽酸,需以上濃鹽酸的體積為________。
(4)將10.0 mL 3.00 mol·L-1的鹽酸與10.0 mL 1.00 mol·L-1的MgCl2溶液混合,則混合溶液中Cl-的物質的量濃度是________。(設混合后溶液的體積不變)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com