
【題目】在一固定容積的密閉容器中,保持一定條件下進行以下反應:A(g)+2B(g)![]() 3C(g)+D(s),已知加入1 molA和3molB。達到平衡后,生成 W mol C。
3C(g)+D(s),已知加入1 molA和3molB。達到平衡后,生成 W mol C。
(1)在相同實驗條件下,若在原平衡的基礎上,向容器中再加入1 mol A和3 mol B,達到平衡后,C的物質的量為_____________mol。
(2)在相同實驗條件下,若在同一容器中改為加入1.5 mol A、6.0 mol B、xmol C和足量的D,若要求在反應混合氣體中C體積分數不變,計算x的值為________。
(3)在相同實驗條件下,若在同一容器中改為加入0.8 mol A、a mol B、b mol C和足量的D,若要使平衡時C為1.2W mol,則a=________,b=________。
【答案】2W 4.5 2.8 1.2
【解析】
(1)恒溫恒容,反應前后氣體體積不變,對應物質按相同的比例加入,平衡等效,物質的轉化率相同,平衡時對應組分的含量相同;
(2)體積分數仍與原平衡相同,說明為等效平衡,恒溫恒容,反應前后氣體體積不變,按化學計量數轉化到左邊,A、B的物質的量之比滿足1:3,則與原平衡等效;
(3)在相同實驗條件下,若要使平衡時C為1.2W mol,則起始量按化學計量數轉化到左邊,A、B的物質的量之比滿足1:3,且為加入1 molA和3molB的1.2倍關系。
(1)恒溫恒容,反應前后氣體體積不變,加入2molA和6molB,A、B的物質的量之比為1:3,與原平衡相同,為等效平衡,物質的轉化率相同,平衡時對應組分的含量相同,C在反應混合氣中的體積分數不變,C的物質的量變為2 W mol。
故答案為:2 W;
(2)恒溫恒容,反應前后氣體體積不變,按化學計量數轉化到左邊,A、B的物質的量之比滿足1:3,則: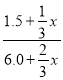 =
=![]() ,解得n=4.5。
,解得n=4.5。
故答案為:4.5;
(3)在相同實驗條件下,若要使平衡時C為1.2W mol,則起始量按化學計量數轉化到左邊,A、B的物質的量之比滿足1:3,且為加入1 molA和3molB的1.2倍關系。則:0.8+![]() =1.2,a+
=1.2,a+![]() =3.6,解得:b=1.2,a=2.8,
=3.6,解得:b=1.2,a=2.8,
故答案為:2.8;1.2。


科目:高中化學 來源: 題型:
【題目】有機化合物G是合成維生素類藥物的中間體,其結構簡式如圖1所示,G的合成路線如圖2所示:
其中A~F分別代表一種有機化合物,合成路線中部分產物及反應條件已略去
已知:-CHO+
請回答下列問題:
(1)G的分子式是__,G中官能團的名稱是__;
(2)第①步反應的化學方程式是__;
(3)B的名稱(系統命名)是__;
(4)第②~⑥步反應中屬于取代反應的有__(填步驟編號);
(5)第④步反應的化學方程式是________;
(6)寫出同時滿足下列條件的E的所有同分異構體的結構簡式__,①只含一種官能團;②鏈狀結構且無﹣O﹣O﹣;③核磁共振氫譜只有2種峰。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時,在一個體積為2L密閉容器中加入反應物A、B,發生如下反應:A(s)+2B(g)![]() 3C(g)。反應過程中的部分數據如下表所示,下列說法正確的是
3C(g)。反應過程中的部分數據如下表所示,下列說法正確的是
物質 | 起始 | 2分鐘 | 4分鐘 | 6分鐘 |
A | 2 mol | 1.2 mol | ||
B | 6 mol | 3.0 mol | ||
C | 0 mol | x mol | 4.5 mol |
A. 前2分鐘內,A的反應速率為0.2molL-1min-1
B. 表中x的值為3.6
C. 4分鐘時,反應達到平衡狀態,此時正、逆反應的速率都為0
D. 升高溫度,正、逆反應的速率都會增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向20 mL N mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH變化曲線如圖所示。下列說法中,正確的是

A.a點c(CH3COOH)=10-3mol·L-1
B.b點溶液中離子濃度大小滿足關系: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c點溶液中離子濃度大小滿足關系: c(Na+)+c(OH-)=c(H+)+c(CH3COO-)
D.滴定過程中不可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢舊硬質合金刀具中含碳化鎢(WC)、金屬鈷(Co)及少量雜質鐵,利用電解法回收WC和制備Co2O3的工藝流程簡圖:

已知:在上述流程中,各種金屬離子形成氫氧化物沉淀的pH范圍如下:
金屬離子 | Fe3+ | Fe2+ | Co2+ |
開始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列問題:
(1)通入氨氣的目的是調節溶液的pH,除去鐵元素。由表中的數據可知,理論上可選擇的pH的范圍是_______。
(2)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若僅從沉淀轉化角度考慮,在0.01mol/L Na2C2O4溶液中加入CoCO3固體能否轉化為CoC2O4沉淀?通過計算說明:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】發酵法制酒精的過程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化學方程式中(C6H10O5)n可能表示_____ ____(填物質名稱);
(2)C6H12O6名稱是_________,常用_____ ____試劑來檢驗其存在;
(3)為檢驗蘋果成熟過程中發生了反應①,可在青蘋果汁中滴加碘酒,溶液呈_________色,向熟蘋果汁中加入Cu(OH)2懸濁液,加熱,反應生成____ ____(填實驗現象);
(4)下列作用不屬于水解反應的是_________
A.吃饅頭時多咀嚼后有甜味
B.淀粉溶液和稀硫酸共熱一段時間后,滴加碘水不顯藍色
C.不慎將濃硝酸沾到皮膚上會出現黃色斑痕
D.油脂與氫氧化鈉溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2017年5月9日中國科學院正式向社會發布113號、115號、117號和118號元素的中文名稱。已知117號元素有多種原子,如![]() 、
、![]() 等。下列說法正確的是
等。下列說法正確的是
A. ![]() 和
和![]() 的化學性質完全不同
的化學性質完全不同
B. 元素Ts的相對原子質量為![]()
C. 基態![]() 原子核外電子共占據7個能級
原子核外電子共占據7個能級
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2的資源化利用能有效減少CO2排放,充分利用碳資源。CaO可在較高溫度下捕集CO2,在更高溫度下將捕集的CO2釋放利用。CaC2O4·H2O熱分解可制備CaO,CaC2O4·H2O加熱升溫過程中固體的質量變化見圖。

①寫出400~600 ℃范圍內分解反應的化學方程式:________。
②與CaCO3熱分解制備的CaO相比,CaC2O4·H2O熱分解制備的CaO具有更好的CO2捕集性能,其原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na、Al、Fe、Cu是中學化學中重要的金屬元素。它們的單質及其化合物之間有很多轉化關系。下表所列物質不能按如圖(“→”表示一步完成)關系相互轉化的是( )
選項 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com