
分析 (1)根據n=$\frac{m}{M}$計算碳酸鈉物質的量,根據n=cV計算溶液中鈉離子物質的量,根據鈉離子守恒計算NaCl物質的量,再根據m=nM計算NaCl的質量;
(2)鈉離子和水分子個數比為1:100,則NaOH與水的物質的量之比為1:100,根據n=nM計算出二者的質量之比,再計算出氫氧化鈉溶液的質量分數;
(3)根據c=$\frac{1000ρω}{M}$及硫酸溶液的濃度越大時,其溶液的密度越大來分析
(4)根據m=ρV可計算質量,1mol原子的質量在數值上等于其相對原子質量.
解答 解:(1)5.3g碳酸鈉的物質的量為:$\frac{5.3g}{106g/mol}$=0.05mol,0.05mol碳酸鈉中含有0.1mol鈉離子,
1L鈉離子濃度為 0.2mol/L的溶液中含有鈉離子的物質的量為:0.2mol/L×1L=0.2mol,
需要加入氯化鈉的物質的量為:0.2mol-0.1mol=0.1mol,0.1molNaCl的質量為:58.5g/mol×0.1mol=5.85g,
故答案為:5.85;
(2)鈉離子和水分子個數比為1:100,則該溶液中氫氧化鈉與水的物質的量之比為1:100,溶液中NaOH與水的質量之比為:1×40:100×18=1:45,則該溶液中氫氧化鈉的質量分數為:$\frac{1}{1+45}$×100%≈2.2%,
故答案為:2.2%(或0.022);
(3)設49%的硫酸溶液的濃度為為c,98%的濃硫酸的密度為ρ1,49%的硫酸溶液的密度為ρ2,
則18.4mol/L=$\frac{1000{ρ}_{1}98%}{98}$、c=$\frac{1000{ρ}_{2}×49%}{98}$,
由硫酸溶液的濃度越大時,其溶液的密度越大,
則ρ1>ρ2,所以c<9.2mol.L-1,
故答案為:小于;
(4)20個原子的質量為 5×(1×10-7)3g=5×10-21g,所以一個原子的質量為:2.5×10-22g,則NA個質量為:6.02×1023×2.5×10-22=150.5g,故摩爾質量為 150.5g/mol,則此元素的原子相對質量約為150,
故答案為:150.
點評 本題考查了物質的量的計算,題目難度中等,涉及質量、溶質質量分數、相對分子質量的計算,明確物質的量與摩爾質量、物質的量濃度等之間的關系為解答關鍵,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 一種分散系中可以有一種分散質,也可以有多種分散質 | |
| B. | 膠體的分散質都能通過過濾從分散劑中分離出來 | |
| C. | 分散劑一定是液體 | |
| D. | 同一種溶質的飽和溶液要比不飽和溶液的濃度大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下22.4LCO2分子數少于NA | B. | 1molNaHCO3固體中含有NA個CO32- | ||
| C. | NA個NO與NA個O2混合分子數為2NA | D. | 1molCu反應轉移電子數一定是2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
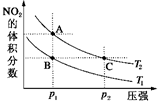 反應N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.正確的是( )
反應N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.正確的是( )| A. | A、C兩點的反應速率:A>C | |
| B. | A、C兩點氣體的顏色:A深,C淺 | |
| C. | A、C兩點氣體的平均相對分子質量:A>C | |
| D. | 由狀態B到狀態A,可以用加熱的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
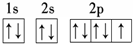
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com