
分析 (1)發生反應:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,計算二氧化硫物質的量,根據方程式計算生成硫酸銅的物質的量;
(2)根據硫元素守恒計算反應后溶液中n(SO42-),再根據c=$\frac{n}{V}$計算SO42-的物質的量濃度.
解答 解:(1)發生反應:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成二氧化硫物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,根據方程式可知生成硫酸銅的物質的量為0.1mol,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;0.1mol;
(2)根據硫元素守恒,反應后溶液中n(SO42-)=0.05L×18mol/L-0.1mol=0.8mol,則稀釋后SO42-的物質的量濃度為$\frac{0.8mol}{0.5L}$=1.6mol/L,
故答案為:1.6mol/L.
點評 本題考查化學方程式計算,難度不大,注意利用守恒法計算反應后硫酸根的物質的量.


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
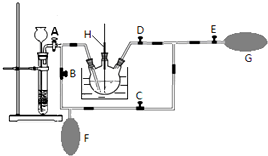
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
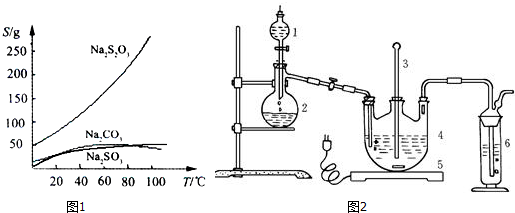

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應物的鍵能總和比生成物的鍵能總和高 | |
| B. | E1為反應物的平均能量與過渡態的能量差,稱為正反應的活化能 | |
| C. | 正反應的熱效應為△H=E1-E2,且E2>E1,所以正反應為放熱反應 | |
| D. | 使用合適的催化劑能同時降低E1和E2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L0.2mol/L CaCl2溶液中含Cl-數為0.2×6.02×1023 | |
| B. | 22gCO2含有0.5mol CO2分子,體積為11.2L | |
| C. | 3.01×1023個水分子的摩爾質量為9g/mol | |
| D. | 3.2g O2和3.2g O3含氧原子的數目相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
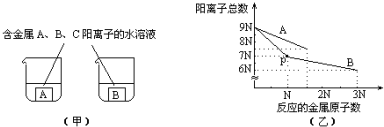
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
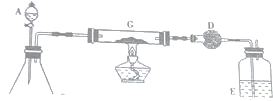
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com