
| A. | 該反應為吸熱反應 | B. | CO2分子中的化學鍵為非極性鍵 | ||
| C. | HCHO分子中含δ鍵又含π鍵 | D. | 每生成1.8gH2O消耗2.24LO2 |
分析 A、根據大多數放熱反應在常溫下能進行來回答;
B.根據不同種元素形成的共價鍵為極性鍵來回答;
C.根據根據一個單鍵就是一個δ鍵,一個雙鍵就是一個δ鍵,一個π鍵,結合物質的結構來判斷;
D.根據氣體的體積與溫度、壓強有關來判斷.
解答 解:A、該反應在室溫下可以進行,故該反應為放熱反應,故A錯誤;
B、二氧化碳結構為O=C=O,為極性鍵,故B錯誤;
C、甲醛中,含有碳氧雙鍵以及兩個碳氫單鍵,故其中3個δ鍵,1個π鍵,故C正確;
D、每生成1.8gH2O消耗氧氣的物質的量為0.1,沒有標明狀況,故不一定為2.24L,故D錯誤;
故選C.
點評 本題以除甲醛氣體為新的情境,考查了化學反應基本理論和基本概念,涉及化學反應中能量變化,分子結構、化學鍵以及氣體的體積等相關知識.


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:選擇題
| 弱酸 | H2CO3 | 水楊酸(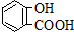 ) ) |
| 電離平衡常數(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常溫下,等濃度、等體積的NaHCO3溶液pH小于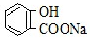 溶液pH 溶液pH | |
| B. | 常溫下,等濃度、等體積的Na2CO3溶液和  溶液中所含離子總數前者小于后者 溶液中所含離子總數前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→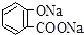 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水楊酸的第二級電離 Ka2 遠小于第一級電離Ka1的原因之一是能形成分子內氫鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
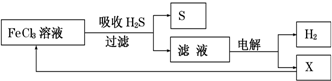
| A. | 吸收H2S的離子方程式為:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 電解時選用陰離子交換膜,電解過程中的陽極區反應主要為:2Cl--2e-=Cl2 | |
| C. | 電解過程中若陰極產生2.24L氣體,則陽極區產生0.2mol Fe3+ | |
| D. | 實驗室可用點燃充分燃燒的方法消除H2S污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,①中形成沉淀的離子方程式為SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的離子方程式為SO42-+Ba2+=BaSO4↓;查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. 也可與Ⅲ發生類似反應③的反應,生成有機物V,V的結構簡式是
也可與Ⅲ發生類似反應③的反應,生成有機物V,V的結構簡式是 .
.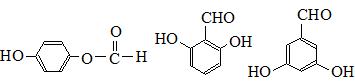 (任寫一種).
(任寫一種).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com