
【題目】某興趣小組探究SO2氣體還原Fe3+、I2,他們使用的藥品和裝置如下圖所示:

FeCl3溶液 /含有淀粉的碘水/NaOH溶液
A B C
(1)SO2氣體還原Fe3+的氧化產物是____________(填離子符號),參加該反應的SO2和Fe3+的物質的量之比是____________。
(2)下列實驗方案適用于在實驗室制取所需SO2的是____________(填序號)。
A.Na2SO3溶液與HNO3 B.Na2SO3固體與濃硫酸
C.固體硫在純氧中燃燒 D.銅與熱濃H2SO4
(3)裝置C的作用是_______________________________________。
(4)若要從A中所得溶液提取晶體,必須進行的實驗操作步驟:蒸發、冷卻結晶、過濾、自然干燥,在這一系列操作中沒有用到的儀器有____________(填序號)。
A.蒸發皿 B.石棉網 C.漏斗 D.燒杯 E.玻璃棒 F.坩堝
(5)在上述裝置中通入SO2,為了驗證A中SO2與Fe3+發生了氧化還原反應,他們取A中的溶液,分成三份,并設計了如下實驗:
方案①:往第二份試液加入鐵氰化鉀溶液,產生藍色沉淀。
方案②:往第一份試液中加入KMnO4溶液,紫紅色褪去。
方案③:往第三份試液加入用稀鹽酸酸化的BaCl2,產生白色沉淀。
上述方案不合理的是________,原因是__________________________________。
(6)能表明I-的還原性弱于SO2的化學方程式為__________________________________。
【答案】 )SO42- 1:2 BD 吸收SO2尾氣,防止污染空氣 BF 方案② 因為A的溶液中含有氯離子(或二氧化硫),氯離子或SO2也能使KMnO4溶液褪色 SO2 + I2 +2H2O == H2SO4 + 2HI
【解析】試題分析:
(1)反應為2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以還原產物是Fe2+,參加反應的SO2和Fe3+的物質的量之比是1:2。
(2)A、硝酸具有強氧化性,把亞硫酸鈉氧化成硫酸鈉,得不到二氧化硫,錯誤;
B、濃硫酸雖具有強氧化性,但不能氧化生成的SO2,正確;
C、固體硫在純氧中燃燒,操作不容易控制,錯誤;
D、銅和濃硫酸在加熱條件下可以制得二氧化硫,正確。
(3)二氧化硫是酸性氧化物,具有刺激性氣味,直接排放污染大氣,能和堿反應生成鹽和水,所以可用堿液處理二氧化硫,所以裝置C的作用是吸收SO2尾氣,防止污染空氣;
(4)操作步驟:蒸發需用到蒸發皿,冷卻結晶需用到燒杯,過濾需用到漏斗、玻璃棒,故不需要石棉網和坩堝。
(5)二氧化硫有還原性,高錳酸鉀有強氧化性,二氧化硫能與高錳酸鉀發生氧化還原反應使高錳酸鉀溶液褪色,Fe2+也使高錳酸鉀溶液褪色,所以不合理的是方案①,因為A的溶液中含有SO2,SO2也能使KMnO4溶液褪色。
(6)I2+SO2+2H2O=2HI+H2SO4;二氧化硫能使含有碘的淀粉溶液褪色,說明發生了氧化還原反應,碘是氧化劑,二氧化硫是還原劑,還原劑的還原性大于還原產物的還原性


 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】下列有關堿金屬和鹵素的說法正確的是( )
A. 從Li到Cs,單質的熔、沸點越來越高
B. 從F到I,單質與H2化合生成的氫化物越來越穩定
C. 從F到I,前一種單質都能把后一種單質從其鹽溶液中置換出來
D. 從Li到Cs,最高價氧化物對應的水化物堿性越來越強,單質與水反應越來越劇烈
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.1 mol·L-1的CH3COOH溶液中,下列關系正確的是
A. c(CH3COOH)>c(H+)>c(CH3COO-) >c(OH-)
B. c(CH3COO-)>c(CH3COOH>c(H+) >c(OH-)
C. c(CH3COOH)>c(CH3COO-)=c (H+)>c(OH-)
D. c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將鐵粉和硫粉混合后加熱,待反應一發生即停止加熱,反應仍可持續進行,直至反應完全生成新物質硫化亞鐵。這現象說明了( )
A.該反應是放熱反應
B.該反應是吸熱反應
C.鐵粉和硫粉在常溫下可以發生反應
D.硫化亞鐵的總能量高于鐵粉和硫粉的總能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學中常用于混合物的分離和提純的裝置,請根據裝置回答問題: 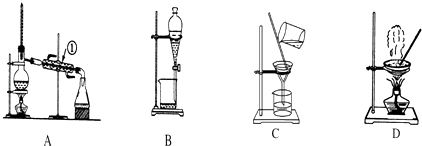
(1)從氯化鉀溶液中得到氯化鉀固體,選擇裝置(填代表裝置圖的字母,下同);除去自來水中的Cl﹣等雜質,選擇裝置 .
(2)從碘水中分離出I2 , 選擇裝置 , 該分離方法的名稱為 .
(3)裝置A中①的名稱是 , 進水的方向是從口(上或下)進水.裝置B在分液時為使液體順利滴下,除打開漏斗下端的旋塞外,還應進行的具體操作是 .
(4)海水中蘊藏著豐富的資源,在實驗室中取少量海水,進行如下流程的實驗: [海水] ![]() [粗鹽]
[粗鹽] ![]() [食鹽水]→[氯化鈉晶體],粗鹽中含Ca2+、Mg2+、Fe3+、SO
[食鹽水]→[氯化鈉晶體],粗鹽中含Ca2+、Mg2+、Fe3+、SO ![]() 等雜質,需要提純后才能綜合利用.粗鹽提純的步驟有:
等雜質,需要提純后才能綜合利用.粗鹽提純的步驟有:
①加入過量的Na2CO3溶液②加入過量的BaCl2溶液③加入過量的NaOH溶液④調節溶液的pH等于7⑤溶解 ⑥過濾⑦蒸發正確的操作順序是(填選項字母)
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵和銅是重要的過度元素,在工農業生產中有重要的作用。回答下列問題:
(1)鐵元素在周期表中的位置__________________________:
(2)將鐵粉、銅粉、FeCl3、FeCl2和CuCl2溶液混合于某容器中充分反應后。
試判斷下列情況下,溶液中存在的金屬離子和金屬單質。
①若鐵粉有剩余,則容器中不可能有:____________;
②若容器內還含有大量的Fe3+,則容器中會有:_______________ ;
③若容器內還有較多的Cu2+和相當量的Cu,則容器內不可能有_______________。
(3)某溶液中含有Fe3+、Br—,如何驗證含有Fe2+________________________________?限定使用的試劑有:KSCN溶液、AgNO3溶液、新制的氯水、稀硝酸、NaOH溶液、酸性KMnO4溶液、雙氧水。
(4)銅的冶煉方法之一:藍銅礦(主要成分是2CuCO3·Cu(OH)2)它與焦炭一起加熱時,可以生成銅、CO2、和水,寫出該反應的化學方程式:________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com