
【題目】雌二醇的結構簡式如圖,下列說法不正確的是
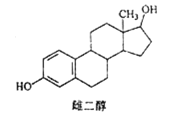
A. 能與 Na、NaOH溶液、Na2CO3溶液反應
B. 能發生加成反應、取代反應、消去反應
C. 該分子中所有碳原子不可能在同一個平面內
D. 可與 FeC13溶液發生顯色反應,但不能發生氧化反應
科目:高中化學 來源: 題型:
【題目】(11分)有機物A(C10H20O2)具有蘭花香味,可用作香皂、洗發香波的芳香賦予劑。已知:
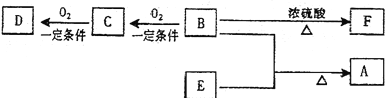
①B分子中沒有支鏈。
②D能與碳酸氫鈉溶液反應放出二氧化碳。
③D、E互為具有相同官能團的同分異構體。E分子烴基上的氫若被Cl取代,其一氯代物只有一種。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以發生的反應有 (選填序號)
①取代反應 ②消去反應 ③加聚反應 ④氧化反應
(2)D、F分子所含的官能團的名稱依次是: 、 。
(3)寫出與D、E具有相同官能團的同分異構體的可能結構簡式:
。
(4)E可用于生產氨芐青霉素等。已知E的制備方法不同于其常見的同系物,據報道,可由2—甲基—1—丙醇和甲酸在一定條件下制取E。該反應的化學方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碲(Te)元素是當今新材料的主要成分之一。工業上從電解法精煉銅的陽極泥中提取純度較高的碲,經預處理后的陽極泥中含TeO2及鐵、鉛、銅的化合物等,通過以下流程得到:

已知:①TeO2是兩性氧化物,微溶于水,可溶于強酸或強堿。
②部分難溶物的Ksp如表:
化合物 | Fe(OH)2 | Pb(OH)2 | Cu(OH)2 | FeS | PbS | CuS |
Ksp | 8×10-16 | 1.2×10-15 | 1.3×10-20 | 4×10-19 | 1×10-28 | 6×10-36 |
回答下列問題:
(1)“堿浸”時TeO2發生反應的化學方程式為___________。
(2)加入Na2S溶液的主要目的是___________。
(3)“沉碲”發生反應的化學方程式為_______。
(4)“酸溶”后,將SO2通入溶液中進行“還原”得到粗碲,該反應的化學方程式是___________。
(5)電解法提純粗碲時,以Na2TeO3溶液為電解質溶液,陽極材料為___________。電解過程中陰極的電極反應式為___________。
(6)常溫下,向0.lmol/LNa2TeO3溶液中滴加鹽酸,當溶液pH=5時,溶液中c(TeO32-):c(H2TeO3)=___________。(已知:H2TeO3的Ka1=1.0×10-3Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.5 mol/L H2SO4溶液500 mL。根據溶液的配制情況回答下列問題:

(1)如圖所示的儀器中配制溶液肯定不需要的是________(填序號)。
(2)下列操作中,500ml容量瓶所不具備的功能有________(填序號)。
A.配制一定體積準確濃度的標準溶液 B.長期貯存溶液
C.用來加熱溶解固體溶質 D.量取220 mL溶液
(3)實驗中,其他操作均正確,若定容時仰視刻度線,則所配制溶液的濃度將____ 0.5mol/L(填“大于”“等于”或“小于”,下同)。若溶液未冷卻即轉移至容量瓶定容,則所配制溶液濃度將________0.5 mol/L。
(4)根據計算得知:所需質量分數為98%、密度為1.84 g/cm3的濃硫酸的體積為________mL(計算結果保留一位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干種,現取X溶液進行連續實驗,實驗過程及產物如圖所示。實驗過程中有一種氣體為紅棕色。
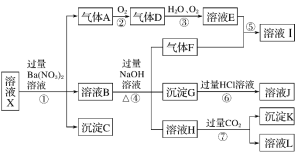
根據以上信息,回答下列問題:
(1)由強酸性條件即可判斷X溶液中肯定不存在的離子有________
(2)溶液X中關于硝酸根離子的判斷,正確的是______(填編號,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)化合物I中含有的化學鍵類型有____________
(4)轉化⑦的離子方程式為____________
(5)對不能確定是否存在的離子,可以另取X溶液,加入下列溶液中的一種,根據現象即可判斷,該試劑最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH試紙 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,向Na2CO3溶液中滴入鹽酸,混合溶液的pH與離子濃度變化的關系如圖所示。

已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列敘述正確的是( )
A. 曲線m表示pH與c(HCO3-)/c(H2CO3)的變化關系
B. 當溶液呈中性時,c(Na+)=c(HCO3-)+2c(CO32-)
C. Ka1(H2CO3)=1.0×10-6.4
D. 25 ℃時,CO32-+H2O![]() HCO3-+OH-的平衡常數為1.0×10-7.6
HCO3-+OH-的平衡常數為1.0×10-7.6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以一種工業廢渣(主要成分為MgCO3、Mg2SiO4和少量Fe、Al的氧化物)為原料制備MgCO3·3H2O。實驗過程如如:
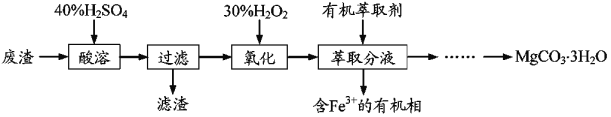
(1)酸溶過程中主要反應的熱化學方程式為
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4kJ·mol–1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4kJ·mol–1
酸溶需加熱的目的是__;所加H2SO4不宜過量太多的原因是__。
(2)加入H2O2氧化時發生發應的離子方程式為__。
(3)用如圖所示的實驗裝置進行萃取分液,以除去溶液中的Fe3+。
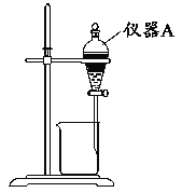
①實驗裝置圖中儀器A的名稱為__。
②為使Fe3+盡可能多地從水相轉移至有機相,采取的操作:向裝有水溶液的儀器A中加入一定量的有機萃取劑,__、靜置、分液,并重復多次。
(4)請補充完整由萃取后得到的水溶液制備MgCO3·3H2O的實驗方案:邊攪拌邊向溶液中滴加氨水,___,過濾、用水洗滌固體2~3次,在50℃下干燥,得到MgCO3·3H2O。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2作為一種廣譜型的消毒劑,將逐漸用來取代Cl2成為自來水的消毒劑。已知ClO2是一種易溶于水而難溶于有機溶劑的氣體,實驗室制備ClO2的原理是用亞氯酸鈉固體與氯氣反應 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下圖是實驗室用于制備和收集一定量較純凈的ClO2的裝置(某些夾持裝置和墊持用品省略)。其中E中盛有CCl4液體(用于除去ClO2中的未反應的Cl2)。
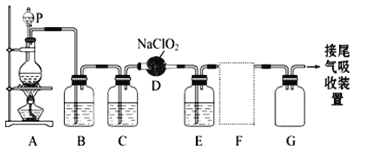
(1)儀器P的名稱是_________________。
(2)寫出裝置A中燒瓶內發生反應的離子方程式:______________________________。
(3)B裝置中所盛試劑是____________________。
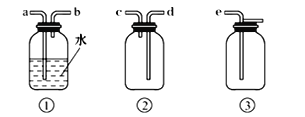
(4)F為ClO2收集裝置,應選用的裝置是___________(填序號),其中與E裝置導管相連的導管口是__________(填接口字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,使用
時,使用![]() 調節溶液
調節溶液![]() 過程中,二元弱酸
過程中,二元弱酸![]() 溶液中含
溶液中含![]() 微粒的分布分數如圖所示。下列敘述中正確的是( )
微粒的分布分數如圖所示。下列敘述中正確的是( )
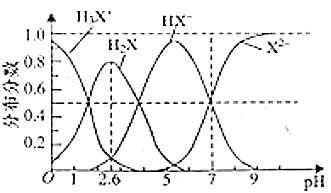
A.溶液![]() 由1升至2.6時主要存在的反應是
由1升至2.6時主要存在的反應是![]()
B.![]() 溶液中
溶液中![]()
C.![]()
D.溶液呈中性時,![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com