
【題目】釩鋼具有高強度、彈性優良、抗磨損、抗沖擊等性能,可用于汽車和飛機制造。一種從石煤(含SiO2、V2O3、V2O5和少量Fe2O3)中提取V2O5的流程如下圖所示:
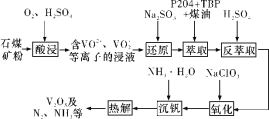
已知:
VO2+ | VO2+ | Fe2+ | Fe3+ | |
P2O4+TBP+煤油中的溶解度 | 很大 | 較小 | 0 | 很大 |
請回答下列問題:
(1)“酸浸”時,為提高浸出速率,除適當增加硫酸濃度、減小石煤礦粉粒徑外,還可采取的措施有__________(任寫一條);生成VO2+反應的離子方程式為_______。
(2)從整個流程來看,“還原”的目的為_______。
(3)實驗室模擬“萃取”時,需用到的玻璃儀器有____________。
(4)“氧化”時發生反應的離子方程式為__________。
(5)上述流程中可以循環利用的物質有_________。
(6)全釩液流儲能電池的工作原理為VO2++V3++H2O![]() VO2++V2++2H+。
VO2++V2++2H+。
①充電時,陽極的電極反應式為______;
②兩極區被質子交換膜隔開,放電時,若外電路轉移2mole-,則正極區溶液中n(H+)________(填“增加”或“減少”)________mol。
【答案】適當升高反應溫度、適當增大O2通入量、攪拌(其他合理答案均可,任寫一條) 2V2O3+8H++O2=4VO2++4H2O 將VO2+還原為VO2+、Fe3+還原為Fe2+,利于后續萃取分離 分液漏斗、燒杯 6VO2++ClO3-+3H2O=6VO2++Cl-+6H+ P2O4+TBP+煤油、NH3(或NH3·H2O) VO2+-e-+H2O=VO2++2H+ 減少 2
【解析】
石煤(含SiO2、V2O3、V2O5和少量Fe2O3)與硫酸和氧氣反應生成的主要是含有VO2+、VO2+、Fe3+,經過亞硫酸鈉還原,變為VO2+、Fe2+,經過P2O4+TBP+煤油的萃取出VO2+,再用硫酸反萃取出VO2+,經過NaClO3的氧化,再加氨水沉釩,再熱解得到V2O5。
⑴由流程圖可知,“酸浸”時需加入O2和H2SO4,為加快反應速率,除了適當增加硫酸濃度、減小石煤礦粉粒徑外,還可采取適當升高反應溫度、適當增大O2通入量、攪拌等措施;生成VO2+反應的離子方程式為2V2O3+8H++O2 = 4VO2++4H2O;故答案為:適當升高反應溫度、適當增大O2通入量、攪拌(其他合理答案均可,任寫一條);2V2O3+8H++O2=4VO2++4H2O。
⑵分析反應流程及表格數據可知,VO2+與Fe3+在P2O4+TBP+煤油中的溶解度很大,而VO2+與Fe2+在萃取劑中的溶解度較小,要除去含鐵雜質,可將VO2+還原為VO2+、Fe3+還原為Fe2+,利于后續萃取分離;故答案為:將VO2+還原為VO2+、Fe3+還原為Fe2+,利于后續萃取分離。
⑶在“萃取”操作中,需用到的玻璃儀器有分液漏斗、燒杯;故答案為:分液漏斗、燒杯。
⑷“氧化”過程為加入NaClO3將VO2+氧化為VO2+,發生反應的離子方程式為6VO2++ClO3-+3H2O = 6 VO2++Cl-+6H+;故答案為:6VO2++ClO3-+3H2O = 6 VO2++Cl-+6H+。
⑸由流程圖可知,該流程進行了“萃取”與“反萃取”,故萃取劑P2O4+TBP+煤油可循環使用,另外“熱解”產生的NH3可配制成NH3·H2O溶液,用于“沉釩”操作;故答案為:P2O4+TBP+煤油、NH3(或NH3·H2O)。
⑹①充電時陽極發生氧化反應,其電極反應式應為VO2+-e-+H2O = VO2++2H+。②放電時正極反應式為VO2++e-+2H+= VO2++H2O,負極反應式為V2+-e-=V3+,故當外電路轉移2mole-時,正極反應消耗4molH+,負極區有2molH+通過質子交換膜移向正極區,故正極區溶液中n(H+)將減少2mol;故答案為:VO2+-e-+H2O=VO2++2H+;減少;2。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)是一種肉制品生產中常見的食品添加劑,使用時必須嚴格控制其用量。在漂白、電鍍等方面應用也很廣泛。某興趣小組設計了如下圖所示的裝置制備NaNO2(A中加熱裝置已略去)。
已知:室溫下,①2NO+Na2O2===2NaNO2
②酸性條件下,NO 或NO2-都能與MnO4-反應生成NO3-和Mn2+
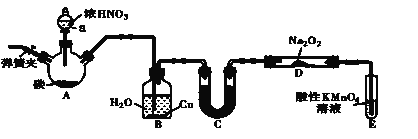
(1)A中發生反應的化學方程式為_________________________________。
(2)檢查完該裝置的氣密性,裝入藥品后,實驗開始前通入一段時間N2,然后關閉彈簧夾,再滴加濃硝酸,加熱。通入N 2的作用是______________。
(3)裝置B中觀察到的主要現象為_________________
(4)①為保證制得的亞硝酸鈉的純度,C裝置中盛放的試劑可能是___________(填字母序號)。
A.P2O5 B.無水CaCl2 C.堿石灰 D.濃硫酸
②如果取消C裝置,D中固體產物除NaNO2外,可能含有的副產物有________ 寫化學式)。
(5)E中發生反應的離子方程式為____________。
(6)將1.56g Na2O2完全轉化為NaNO2,理論上至少需要木炭__________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
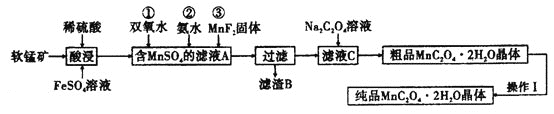
【題目】![]() 是一種常見的化學試劑,是制備其他含錳化合物的重要原料。某課外化學興趣小組利用軟錳礦
是一種常見的化學試劑,是制備其他含錳化合物的重要原料。某課外化學興趣小組利用軟錳礦![]() 主要成分為
主要成分為![]() ,含少量
,含少量![]() 、
、![]() 和
和![]() 制備
制備![]() ,設計流程如圖:
,設計流程如圖:![]() 注:試劑①②③按編號順序加入
注:試劑①②③按編號順序加入![]()
已知:常溫時部分難溶化合物的![]() 近似值
近似值![]() 如表:
如表:
物質 |
|
|
|
|
|
|
|
|
|
|
|
(1)該小組同學在酸浸之前,先將軟錳礦粉碎,其目的是________。
(2)“酸浸”過程中![]() 發生反應的離子方程式為________。
發生反應的離子方程式為________。
(3)加入![]() 固體的作用是________,甲同學提出將上述流程中的氨水換成氫氧化鈉溶液,乙同學覺得不妥,乙同學的理由是________。
固體的作用是________,甲同學提出將上述流程中的氨水換成氫氧化鈉溶液,乙同學覺得不妥,乙同學的理由是________。
(4)丙同學認為向濾液C中滴加![]() 溶液的過程中可能會生成
溶液的過程中可能會生成![]() 沉淀,并提出可能的原因為
沉淀,并提出可能的原因為![]() ,常溫時,該反應的平衡常數
,常溫時,該反應的平衡常數![]() ________
________![]() 填數值
填數值![]() 。
。![]() 已知
已知![]() ,
,![]() 。
。
(5)操作Ⅰ的名稱為________。
(6)如圖是小組同學將![]() 晶體放在坩堝里加熱分解時,固體失重質量分數隨溫度
晶體放在坩堝里加熱分解時,固體失重質量分數隨溫度![]() 變化的曲線
變化的曲線![]() 已知草酸錳不穩定,但其中錳元素的化合價在
已知草酸錳不穩定,但其中錳元素的化合價在![]() 以下不變
以下不變![]() 。
。
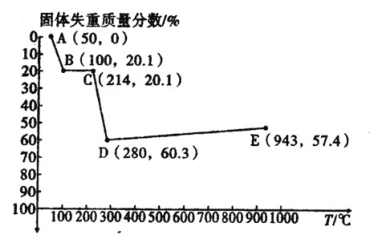
試根據各點的坐標![]() 近似值
近似值![]() 回答下列問題:
回答下列問題:
①![]() 的化學方程式為________。
的化學方程式為________。
②從D點到E點過程中固體失重的質量分數下降的原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】油脂是重要的營養物質.某天然油脂A可發生下列反應:
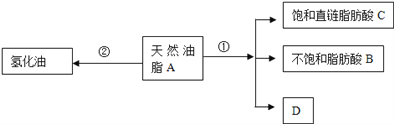
已知:A的分子式為C57H106O6.1mol該天然油脂A經反應①可得到1molD、1mol不飽和脂肪酸B和2mol直鏈飽和脂肪酸C.經測定B的相對分子質量為280,原子個數比為C:H:O=9:16:1;
(1)寫出B的分子式:________________________;
(2)寫出反應①的反應類型:____________;C的名稱(或俗稱)是_________;
(3)近日,電視媒體關于“氫化油危害堪比殺蟲劑”的報道引發軒然大波,反應②為天然油脂的氫化過程.下列有關說法不正確的是_______________;
a.氫化油又稱人造奶油,通常又叫硬化油.
b.植物油經過氫化處理后會產生副產品反式脂肪酸甘油酯,攝入過多的氫化油,容易堵塞血管而導致心腦血管疾病.
c.氫化油的制備原理是在加熱植物油時,加入金屬催化劑,通入氫氣,使液態油脂變為半固態或固態油脂.
d.油脂的氫化與油脂的皂化都屬于加成反應
(4)D和足量金屬鈉反應的化學方程式_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一個平面上
C. 煤油可由石油分餾獲得,可用作燃料和保存少量金屬鈉
D. ![]() 和CH3-CH=CH2互為同分異構體
和CH3-CH=CH2互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有短周期主族元素X、Y、Z、R、T,R原子最外層電子數是電子層數的2倍;Y與Z能形成Z2Y、Z2Y2型離子化合物,Z與T形成的Z2T型化合物能破壞水的電離平衡,五種元素的原子半徑與原子序數的關系如圖所示。下列推斷正確的是( )
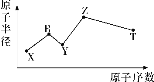
A.原子半徑和離子半徑均滿足:Y<Z
B.簡單氫化物的沸點和熱穩定性均滿足:Y>T
C.最高價氧化物對應的水化物的酸性:T<R
D.常溫下,0.1mol·L-1由X、Y、Z、T四種元素組成的化合物的水溶液的pH一定大于1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以紅土鎳礦(主要含有Fe2O3、FeO、NiO、SiO2等)為原料,獲取凈水劑黃鈉鐵礬[NaFe(SO4)2(OH)6]和納米鎳粉的部分工藝流程如下:
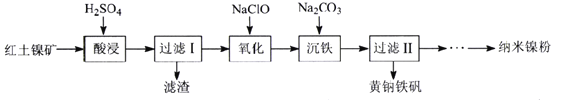
(1)“酸浸”過程,為提高鐵和鎳元素的浸出率,可采取的措施有___________(寫出兩種)。
(2)“過濾Ⅰ”濾渣的主要成分是______。
(3)“氧化”過程欲使0.3molFe2+轉變為Fe3+,則需氧化劑NaClO至少為________ mol。
(4)“沉鐵”過程中加入碳酸鈉調節浴液的pH至2,生成黃鈉鐵礬沉淀,寫出該反應的化學方程式______。若碳酸鈉過多會導致生成的沉淀由黃鈉鐵礬轉變為_____(填化學式)。
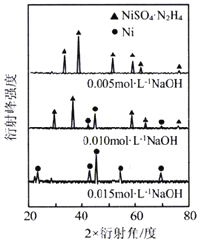
(5)向“過濾Ⅱ”所得濾液(富含Ni2+)中加入N2H4·H2O,在不同濃度的氫氧化鈉溶液中反應,含鎳產物的XRD圖譜如下圖所示(XRD圖譜可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同)。欲制得高純納米鎳粉最適宜的NaOH的物質的量濃度為_____。寫出該條件下制備納米鎳粉同時生成N2的離子方程式_____。
(6)高鐵酸鹽也是一種優良的含鐵凈水劑,J.C.Poggendor早在1841年利用純鐵作電極插入濃的NaOH溶液電解制得Na2FeO4,陽極生成FeO42-的電極反應式為______;Deininger等對其進行改進,在陰、陽電極間設置陽離子交換膜,有效提高了產率,陽離子交換膜的作用是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學科研小組研究在其他條件不變時,改變某一條件對化學平衡的影響,得到如圖所示變化規律(p表示壓強,T表示溫度,n表示物質的量):根據以上規律判斷,下列結論正確的是( )
A.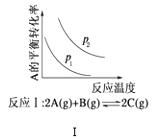 反應Ⅰ:△H>0,p2>p1
反應Ⅰ:△H>0,p2>p1
B.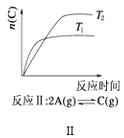 反應Ⅱ:△H>0,T1>T2
反應Ⅱ:△H>0,T1>T2
C. 反應Ⅲ:△H>0,T2>T1或△H<0,T2<T1
反應Ⅲ:△H>0,T2>T1或△H<0,T2<T1
D.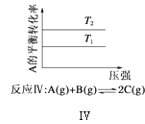 反應Ⅳ:△H<0,T2>T1
反應Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋動物海鞘中含有種類豐富、結構新穎的次生代謝產物,是海洋抗腫瘤活性物質的重要來源之一。一種從海鞘中提取具有抗腫瘤活性的天然產物的流程如下:
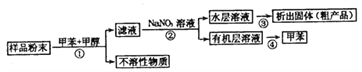
下列關于該流程中各步驟的說法中,錯誤的是( )
選項 | 步驟 | 采用裝置 | 主要儀器 |
A | ① | 過濾裝置 | 漏斗 |
B | ② | 分液裝置 | 分液漏斗 |
C | ③ | 蒸發裝置 | 坩堝 |
D | ④ | 蒸餾裝置 | 蒸餾燒瓶 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com