
實現 “節能減排” 和“低碳經濟”的一項重要課題就是如何將CO2轉化為可利用的資源。目前工業上有一種方法是用CO2來生產燃料甲醇。一定條件下發生反應:
 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下圖1表示該反應過程中能量變化:
CH3OH(g)+H2O(g),下圖1表示該反應過程中能量變化:
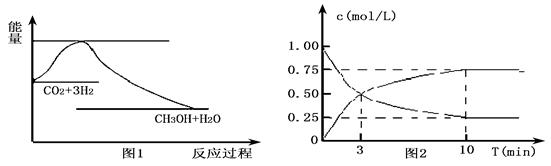
(1)關于該反應的下列說法中,正確的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
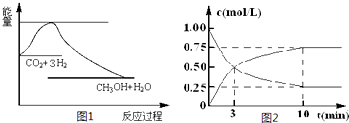
(2)為探究反應原理,現進行如下實驗,在體積為l L的密閉容器中,充入l mol
CO2和4mol H2,一定條件下發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g),測得CO2和CH3OH(g)的濃度隨時間變化如上圖2所示。
CH3OH(g)+H2O(g),測得CO2和CH3OH(g)的濃度隨時間變化如上圖2所示。
①從反應開始到平衡,CO2的平均反應速率v(CO2)= ;
H2的轉化率w(H2) = 。
②該反應的平衡常數表達式K= 。
③下列措施中能使化學平衡向正反應方向移動的是 (填字母)。
A.升高溫度
B.將CH3OH(g)及時液化抽出
C.選擇高效催化劑
(3)25℃,1.01×105Pa時,16g液態甲醇完全燃燒,當恢復到原狀態時,放出363.3kJ的熱量,寫出該反應的熱化學方程式:_____________。
(1) C (2)①0.075mol·L-1·min-1 56.25%② 略, ③ B
(3)CH3OH(l)+ O2 =CO2(g)+2H2O(l) △H=-726.6 kJ·mol-1
O2 =CO2(g)+2H2O(l) △H=-726.6 kJ·mol-1
【解析】
試題分析:(1)根據圖1可知,反應物的總能量高于生成物的總能量,所以反應是放熱反應。根據方程式可知,該反應是體積減小的可逆反應,所以△S小于0,答案選C。
(2)①根據圖像可知,反應進行到10min是物質的濃度不再發生變化,說明反應達到平衡狀態,則從反應開始到平衡,CO2的平均反應速率v(CO2)=(1.0-0.25)mol/L÷10min=0.075 mol·L-1·min-1;消耗氫氣的物質的量濃度是(1.0-0.25)mol/L×3,則H2的轉化率w(H2) = 。
。
②平衡時CO2和氫氣的濃度分別是0.25mol/L和1.75mol/L,生成物甲醇和水的濃度都是0.75mol/L,所以該反應的平衡常數K=
③正方應是放熱反應,升高溫度平衡向逆反應方向移動。將CH3OH(g)及時液化抽出,相當于是降低生成物濃度,平衡向正反應方向移動;催化劑不能影響平衡狀態,所以答案選B。
(3)16g甲醇的物質的量是0.5mol,燃燒放出363.3kJ的熱量,所以該反應的熱化學方程式CH3OH(l)+ O2 =CO2(g)+2H2O(l) △H=-726.6 kJ·mol-1。
O2 =CO2(g)+2H2O(l) △H=-726.6 kJ·mol-1。
考點:考查反應熱、熵變、反應速率、化學平衡常數、外界條件對平衡狀態的影響以及熱化學方程式的書寫
點評:該題是中等難度的試題,試題綜合性強,貼近高考。在注重對學生教材基礎知識鞏固和訓練的同時,側重對學生能力的培養,意在提高學生靈活運用基礎知識解決實際問題的能力,有利于調動學生的學習興趣和學習積極性,提高學生的應試能力。


 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| ||
| 催化劑 |
| 加熱 |
| 催化劑 |
| 加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| C(CH3OH)?C(H2O) |
| C(CO2)?C3(H2) |
| C(CH3OH)?C(H2O) |
| C(CO2)?C3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 催化劑 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、食品包裝袋、食物保鮮膜等材料的主要成份是聚氯乙烯,也就是PVC保鮮膜 | B、三聚氰胺(cyanuramide,分子式C3H6N6)含氮量很高,但不可作為飼料添加劑 | C、福州市加大投入LNG(液體天然氣)、CNG(壓縮天然氣)公交車、出租車,目的是為了實現節能減排、低碳環保 | D、腌制食品中嚴格控制NaNO2的用量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com