
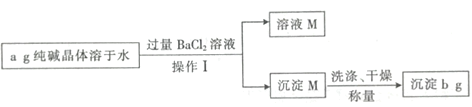
【題目】純堿晶體![]() 樣品中常混有NaCl等雜質。某同學用沉淀法測定樣品中
樣品中常混有NaCl等雜質。某同學用沉淀法測定樣品中![]() 的質量分數,操作流程如下:
的質量分數,操作流程如下:
(1)寫出加入![]() 溶液反應的離子方程式____;操作I所用到的玻璃儀器有燒杯、玻璃棒、____。
溶液反應的離子方程式____;操作I所用到的玻璃儀器有燒杯、玻璃棒、____。
(2)對沉淀M洗滌的方法是___。
(3)樣品中![]() 的質量分數為___。
的質量分數為___。
(4)如果純堿晶體失去部分結晶水(風化),則測定結果會___(填“偏高”、“偏低”或“不變”)。
(5)純堿在生產生活中有廣泛應用,用途正確的是_____。
A 用于治療胃酸過多 B 用于生產玻璃 C 用于造紙 D 用于焙制糕點
【答案】CO32-+Ba2+=BaCO3↓ 漏斗 沿玻璃棒向過濾器中加入蒸餾水至浸沒沉淀,待水自然流下后,重復操作2~3次,直至洗滌干凈即可 ![]() % 偏高 BC
% 偏高 BC
【解析】
根據流程圖可知,純堿晶體樣品中常混有NaCl等雜質,溶于水后形成碳酸鈉與氯化鈉的混合溶液,加入過量氯化鋇溶液,碳酸鈉與氯化鋇反應生成碳酸鋇沉淀和氯化鈉,經過濾操作得沉淀M為碳酸鋇,溶液M為氯化鈉與氯化鋇的混合溶液,據此回答。
根據流程圖可知,純堿晶體樣品中常混有NaCl等雜質,溶于水后形成碳酸鈉與氯化鈉的混合溶液,加入過量氯化鋇溶液,碳酸鈉與氯化鋇反應生成碳酸鋇沉淀和氯化鈉,經過濾操作得沉淀M為碳酸鋇,溶液M為氯化鈉與氯化鋇的混合溶液;
(1)碳酸鈉與氯化鋇反應的離子方程式為:CO32-+Ba2+=BaCO3↓,操作Ⅰ為過濾,用到的玻璃儀器有燒杯、玻璃棒和漏斗;故答案為:CO32-+Ba2+=BaCO3↓;漏斗;
(2)洗滌沉淀的方法是:沿玻璃棒向過濾器中加入蒸餾水至浸沒沉淀,待水自然流下后,重復操作2~3次,直至洗滌干凈即可;故答案為:沿玻璃棒向過濾器中加入蒸餾水至浸沒沉淀,待水自然流下后,重復操作2~3次,直至洗滌干凈即可;
(3)由分析可知,碳酸鋇質量為bg,n(BaCO3)=![]() =
=![]() mol,則n(Na2CO3)= n(BaCO3)=
mol,則n(Na2CO3)= n(BaCO3)=![]() mol,m(Na2CO3)=
mol,m(Na2CO3)=![]() mol
mol![]() =
=![]() g,質量分數為:
g,質量分數為: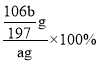 =
=![]() %;故答案為:
%;故答案為:![]() %;
%;
(4)如果純堿晶體失去部分結晶水,則樣品質量偏小,會導致測定結果偏高;故答案為:偏高;
(5)純堿主要應用于玻璃制造業、化學工業、冶金工業、以及造紙、肥皂、紡織、印染、食品等輕工業,小蘇打可以用于治療胃酸過多和焙制糕點,故答案為:BC。


科目:高中化學 來源: 題型:
【題目】如圖裝置中,有如下實驗現象:開始時插在小試管中的導管內的液面下降,一段時間后導管內的液面回升,略高于U型管中的液面。以下有關解釋不合理的是

A. 生鐵片中所含的碳能增強鐵的抗腐蝕性
B. 雨水酸性較強,生鐵片開始發生析氫腐蝕
C. 導管內墨水液面回升時,正極反應式:O2+2H2O+4e—==4OH-
D. 隨著反應的進行,U型管中雨水的酸性逐漸減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種鎂氧電池如圖所示,電極材料為金屬鎂和吸附氧氣的活性炭,電解液為KOH濃溶液。下列說法不正確的是( )

A.電池總反應式為:2Mg+ O2+2H2O=2Mg(OH)2
B.正極反應式為:Mg-2e-=Mg2+
C.活性炭可以加快O2在電極上的反應速率
D.電子的移動方向由a經外電路到b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海帶中提取碘的一種工業生產過程如下:

下列說法中錯誤的是
A.步驟(1)需要過濾裝置
B.步驟(2)需要用到分液漏斗
C.“堿化”目的是讓可溶性有機質形成沉淀
D.“氧化”是讓I-轉化為I2,可以用適量氯氣作氧化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家最近在-100 ℃的低溫下合成了一種烴X,紅外光譜和核磁共振氫譜表明其分子中的氫原子所處的化學環境沒有區別,根據分析,繪制了該分子的球棍模型如圖所示。下列說法中不正確的是( )

A. 該分子的分子式為C5H4
B. 該分子中碳原子的化學環境有2種
C. 該分子中的氫原子分布在兩個相互垂直的平面上
D. 該分子中只有C—C鍵,沒有![]() 鍵
鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇水蒸氣重整制氫方法是目前比較成熟的制氫方法,且具有良好的應用前景。甲醇水蒸氣重整制氫的部分反應過程如圖所示:
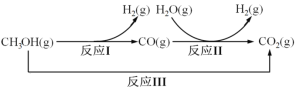
(1)已知一定條件下
反應I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反應III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
該條件下反應II的熱化學方程式是___。
(2)已知反應II在進氣比[n(CO):n(H2O)]不同時,在不同溫度(T1、T2)下,測得相應的CO的平衡轉化率見圖。
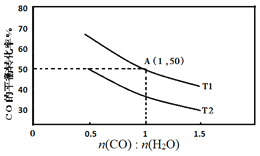
①比較T1、T2的大小,并解釋原因___。
②A點對應的化學平衡常數是___。
③T1溫度時,按下表數據開始反應建立平衡。
CO | H2O | H2 | CO2 | |
起始濃度(mol/L) | 2 | 1 | 0 | 0 |
t時刻濃度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反應進行到t時刻時,判斷v(正)、v(逆)的大小關系為:v(正)__v(逆)(填“>”“<”或“=”)。
④當不同的進氣比達到相同的CO平衡轉化率時,對應的反應溫度和進氣比的關系是___。
(3)在經CO2飽和處理的KHCO3電解液中,電解活化CO2可以制備乙醇,原理如圖所示。
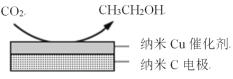
①陰極的電極反應式是___。
②從電解后溶液中分離出乙醇的操作方法是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物Bilirubin在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如下圖所示,計算反應4~8 min間的平均反應速率和推測反應16 min時反應物的濃度,結果應是( )
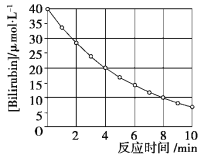
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列不屬于氧化還原反應的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(濃)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com