
【題目】下列離子方程式書寫正確的是
A. 鐵和鹽酸溶液反應:2Fe + 6H+ === 2Fe3+ +3 H2↑
B. 氯氣和水反應:Cl2 + H2O![]() 2 H+ + Cl- + ClO
2 H+ + Cl- + ClO
C. 氫氧化鋇溶液與硫酸銅溶液反應:Ba2+ + SO42- = BaSO4↓
D. 氯化鐵溶液與氨水溶液反應: Fe3+ + 3 NH3·H2O === Fe (OH)3 ↓+ 3NH4+
科目:高中化學 來源: 題型:
【題目】某鹽 A是由三種元素組成的化合物,某研究小組按如圖流程探究其組成:
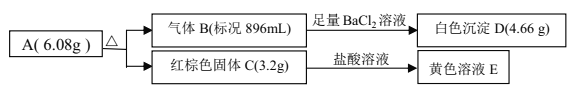
請回答:
(1)寫出紅棕色固體 C 的化學式____________。
(2)寫出 A 受熱分解反應的化學方程式____________。
(3)寫出氣體 B 與溶液 E 反應的離子方程式____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】各組物質不屬于同分異構體的是( )
A.2,2-二甲基-1-丙醇和2-甲基-1-丁醇
B.對氯甲苯和鄰氯甲苯
C.2-甲基丁烷和戊烷
D.甲基丙烯酸和甲酸丙酯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦白粉(金紅石晶型 TiO2)被廣泛用于制造高級白色油漆。工業上以鈦鐵礦(主要成分為 FeTiO3,含有 Fe2O3 和 SiO2 等雜質)為原料制鈦白粉的主要工藝如下:
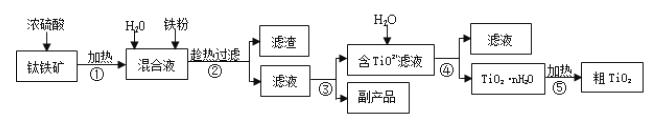
回答下列問題:
(1)第②步所得濾渣的成分是________。
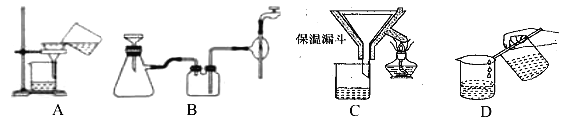
(2)操作④中需要控制條件以形成 TiO2·nH2O 溶膠,該工藝過程若要在實驗室里完成,其中的“過濾”操作,可選用下列裝置________(填選項)。
(3)第③步的實驗操作是______、過濾,從而獲得副產品 FeSO4·7H2O。
(4)為測定操作③所得濾液中TiO2+的濃度,取待測濾液10 mL 用蒸餾水稀釋至100 mL,加入過量鋁粉,充分振蕩,使其完全反應:3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O。過濾后,取出濾液20.00 mL(加鋁粉時引起溶液體積的變化忽略不計),向其中滴加2~3 滴KSCN溶液作指示劑,用 0.1000 mol·L-1NH4Fe(SO4)2 標準溶液滴定至溶液出現紅色,此時溶液中 Ti3+全部被氧化為 Ti4+,消耗標準液30.00mL。回答下列問題:
①下列操作會使所測 TiO2+濃度偏高的是______。
A. 在配制標準液的過程中,未洗滌燒杯和玻璃棒
B. 在配制標準液定容是俯視刻度線
C.用蒸餾水洗滌后未經潤洗的滴定管取待測液
D.在滴定終點讀數時仰視滴定管刻度線
②求得待測濾液中 TiO2+的物質的量濃度是______。
(5)科學家從電解冶煉鋁的工藝中得到啟發,找出了冶煉鈦的新工藝—TiO2 直接電解法生產鈦,電解質為熔融的氯化鈣,原理如圖所示。
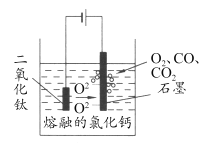
寫出陰極電極反應式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為足量銅與濃硫酸反應的裝置。請回答:
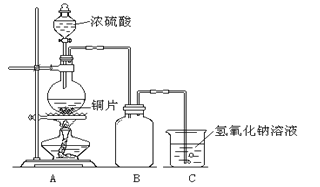
(1)寫出盛放有銅片的儀器名稱____________。
(2)檢查裝置氣密性的操作為____________。
(3)下列有關該實驗的說法中正確的是____________。
A.燒杯中氫氧化鈉溶液的作用是吸收尾氣,防止空氣污染
B.實驗時可以觀察到圓底燒瓶中溶液由無色最終變為藍色
C.含 0.08 mol 溶質的濃硫酸與足量的銅片反應,能收集到896mL(標準狀況)的SO2
D.在該實驗中濃硫酸體現了酸性和強氧化性
E.如果 B 中盛有少量 KMnO4 溶液,反應一段時間后,可以觀察到紫色褪去,說明SO2具有漂白性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置)。僅用此裝置和表中提供的物質完成相關實驗,最合理的選項是

選項 | a中的物質 | b中的物質 | c中收集的氣體 | d中的物質 |
A | 濃氨水 | CaO | NH3 | H2O |
B | 濃硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 濃鹽酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com