
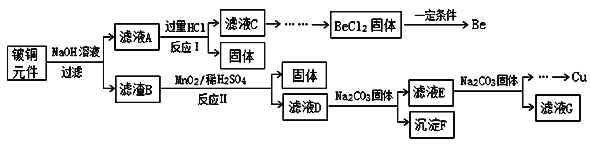
【題目】鈹銅是廣泛應用于制造高級彈性元件的良好合金。某科研小組從某廢舊鈹銅元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收鈹和銅兩種金屬的工藝流程如圖:
已知:I、鈹、鋁元素化學性質相似;
Ⅱ、常溫下部分難溶物的溶度積常數如表:
難溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度積常數(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)濾液A的主要成分除NaOH、Na2BeO2外,還有___________(填化學式),寫出反應I中Na2BeO2與過量鹽酸反應的離子方程式:________。
(2)濾液C中含NaCl、BeCl2和少量HCl,為提純BeCl2,最合理的實驗步驟順序為_______(填字母)
a.加入過量的氨水 b.通入過量的CO2 c.加入過量的NaOH d.加入適量的HCl e.洗滌 f.過濾
(3)MnO2能將金屬硫化物中的硫元素氧化為硫單質,寫出反應Ⅱ中CuS發生反應的化學方程式:___________。若用濃HNO3溶解金屬硫化物,缺點是_______(任寫一條)。
(4)濾液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=8.0×10-3mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入Na2CO3溶液調節pH可將其轉變成氫氧化物依次分離,首先沉淀的是_______(填離子符號);為使銅離子開始沉淀,常溫下應調節溶液的pH大于______。
【答案】Na2SiO3 BeO22-+4H+=Be2++2H2O afed MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O 會產生污染環境的氣體 Fe3+ 4
【解析】
廢舊鈹銅元件(含BeO:25%、CuS:71%、少量FeS和SiO2)加入過量的氫氧化鈉溶液,濾液A含有氫氧化鈉、Na2SiO3、Na2BeO2等,濾液B含有CuS、FeS,加入二氧化錳、稀硫酸,發生氧化還原反應,固體含有S,濾液D含有硫酸錳、硫酸銅以及硫酸鐵等,加入Na2CO3,可生成氫氧化鐵、氫氧化銅等沉淀,以此解答該題。
(1)BeO具有氧化鋁的性質,為兩性氧化物,且二氧化硅與氫氧化鈉溶液反應,可知濾液A的主要成分除NaOH、Na2BeO2外,還有Na2SiO3,反應I中含鈹化合物與過量鹽酸反應的離子方程式為BeO22-+4H+=Be2++2H2O,故答案為:Na2SiO3;BeO22-+4H+=Be2++2H2O;
(2)溶液C中含NaCl、BeCl2和少量HCl,為提純BeCl2,可先加入過量的氨水生成Be(OH)2,過濾,洗滌后再加入鹽酸,可生成BeCl2,則順序為afed,故答案為:afed;
(3)MnO2能將金屬硫化物中的硫元素氧化為硫單質,與CuS反應,還可生成硫酸銅、硫酸錳,反應的化學方程式為MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O,用濃HNO3溶解金屬硫化物,可生成二氧化氮等氣體,污染環境,故答案為:MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O;會產生污染環境的氣體;
(4)常溫下:Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038,Ksp[Mn(OH)2]=2.1×1013,溶液D 中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,如分別生成沉淀,需要分別為c(OH)=![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L,可知Fe3+的c(OH)最小,最先生成沉淀,使銅離子開始沉淀,則c(OH)=
mol/L,可知Fe3+的c(OH)最小,最先生成沉淀,使銅離子開始沉淀,則c(OH)=![]() mol/L=1×1010mol/L,pH應大于4,故答案為:Fe3+;4。
mol/L=1×1010mol/L,pH應大于4,故答案為:Fe3+;4。


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】煤的氣化就是將煤轉化為可燃氣體的過程。水蒸氣通過灼熱的煤所產生的混和氣,其主要成份是CO、H2還含有CO2和水蒸氣。用下列裝置檢驗混和氣中部分物質,下列說法不正確的是( )
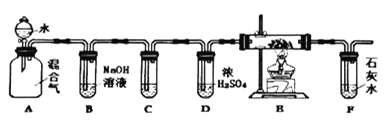
A.若A和B之間增加裝無水CuSO4的干燥管可檢驗H2O的存在
B.若試管C和E中分別裝澄清石灰水、CuO,可檢驗CO的存在
C.在裝置F之后,應該放置一只燃著的酒精燈,防止CO污染空氣
D.工業上將煤氣化,其目的是獲得潔凈的燃料和化工原料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高氯酸三碳酰肼合鎳{[Ni(CHZ)3](ClO4)2}是一種新型的起爆藥。
(1)Ni能與CO形成配合物Ni(CO)4,配體CO中提供孤電子對的是C原子,其理由可能是__;該配合物分子中σ鍵與π鍵數目之比為__。
(2)①ClO4-的空間構型是___。
②寫出與ClO4-互為等電子體的一種分子和一種離子:__、__。(填化學式)
(3)化學式中CHZ為碳酰肼,其結構為![]() ,它是一種新型的環保鍋爐水除氧劑。
,它是一種新型的環保鍋爐水除氧劑。
①碳酰肼中氮元素的化合價為__,碳原子的雜化軌道類型為__。
②碳酰肼可以由碳酸二甲酯(![]() )和肼(N2H4)反應制得,有關的化學方程式為__。
)和肼(N2H4)反應制得,有關的化學方程式為__。
(4)高氯酸三碳酰肼合鎳可由NiO、高氯酸及碳酰肼化合而成。
①比較次氯酸和高氯酸的酸性,并說明理由:___。
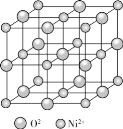
②如圖為NiO晶胞,若晶胞中含有的Ni2+數目為a,Ni2+的配位數為b,NiO晶體中每個Ni2+距離最近的Ni2+數目為c,則a:b:c=__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以鉻鐵礦[主要成份為Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等雜質]為主要原料生產重鉻酸鈉晶體(Na2Cr2O7·2H2O)的主要工藝流程如圖:
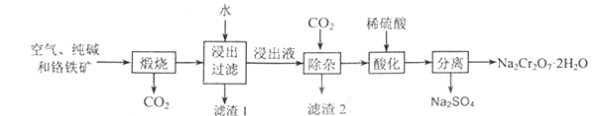
(1)煅燒過程中,鉻鐵礦中的Al2O3與純堿反應的化學方程式為:____。
(2)濾渣1的成分為_____,濾渣2的成分為_____。
(3)該工藝中某種產物可以再利用,該物質的化學式為:_____。
(4)酸化時發生的反應為:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含鉻元素的質量為28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含鉻元素的質量為28.6g,CrO42-有![]() 轉化為Cr2O72-。
轉化為Cr2O72-。
①酸化時發生反應的平衡常數的表達式為K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根據有關國家標準,含CrO42-的廢水要經化學處理,使其濃度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的廢水處理通常有以下兩種方法。
①沉淀法:加入可溶性鋇鹽生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸鹽處理多余的Ba2+。加入可溶性鋇鹽后的廢水中Ba2+的濃度應不小于____mol·L-1,后續廢水處理方能達到國家排放標準。
②還原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。寫出酸性條件下CrO42-與綠礬反應的離子方程式____。
Cr(OH)3。寫出酸性條件下CrO42-與綠礬反應的離子方程式____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是8種有機化合物的轉換關系:
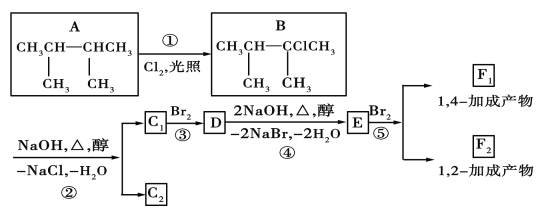
請回答下列問題:
(1)化合物E中含有的官能團的名稱為___。
(2)上述框圖中,①是___反應,③是___反應(填反應類型)。
(3)化合物E是重要的工業原料,寫出由D生成E的化學方程式:___。
(4)C1的結構簡式是___;F1的結構簡式是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 室溫下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用鋁粉和NaOH溶液反應制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室溫下用稀HNO3溶解銅:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可溶性鋇鹽有毒,醫院中常用硫酸鋇這種鋇鹽(俗稱鋇餐)作為內服造影劑。醫院搶救鋇離子中毒患者時除催吐外,還需要向中毒者胃中灌入硫酸鈉溶液。已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推斷正確的是
A.BaCO3的溶度積常數表達式為 Ksp(BaCO3)= n(Ba2+)·n(CO32-)
B.可用2%~5%的Na2SO4溶液給鋇離子中毒患者洗胃
C.若誤服含c(Ba2+)=1.0×10-5 mol·L-1的溶液時,會引起鋇離子中毒
D.不用碳酸鋇作為內服造影劑,是因為Ksp(BaCO3)>Ksp(BaSO4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A(g)+3B(g)![]() 2C(g)+2D(g)在不同情況下的反應速率,其中的反應速率最快的是
2C(g)+2D(g)在不同情況下的反應速率,其中的反應速率最快的是
A. v(A)=0.20 mol/(L·s) B. v(B)=0.30 mol/(L·s)
C. v(C)=0.50 mol/(L·s) D. v(D)=0.60 mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】痛滅定鈉是一種吡咯乙酸類的非甾體抗炎藥,其合成路線如圖:
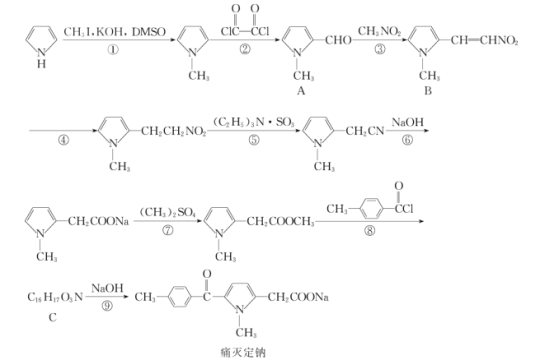
回答下列問題:
(1)化合物B中含有官能團的名稱是__。
(2)化學反應①和④的反應類型分別為__和__。
(3)化合物C的結構簡式為__。
(4)下列關于痛滅定鈉的說法錯誤的是__。
a.與溴充分加成后官能團種類數不變
b.能夠發生水解反應
c.核磁共振氫譜分析能夠顯示6個峰
d.可使溴的四氯化碳溶液褪色
e.1mol痛滅定鈉與氫氣加成最多消耗3molH2
(5)反應⑦的化學方程式為__。
(6)芳香族化合物X的相對分子質量比A大14,寫出遇FeCl3溶液顯紫色且取代基僅位于苯環對位上化合物X的結構簡式:__(不考慮立體異構)。
(7)根據該試題提供的相關信息,寫出由化合物![]() 及必要的試劑制備有機化合物
及必要的試劑制備有機化合物![]() 的合成路線圖。__。
的合成路線圖。__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com