
 甲醇是一種可再生能源,具有廣泛的開發和應用前景.
甲醇是一種可再生能源,具有廣泛的開發和應用前景.分析 (3)①“原子經濟性”是指在化學品合成過程中,合成方法和工藝應被設計成能把反應過程中所用的所有原材料盡可能多的轉化到最終產物中;
②反應物總能量大于生成物總能量時,該反應為放熱反應;
③根據一氧化碳的平衡濃度計算平衡時一氧化碳的物質的量,再根據轉化率公式計算其轉化率;
(4)①該燃料電池中,負極反應為CH3OH-6e-+2OH-=CO32-+3H2O,正極上氧氣得電子發生還原反應,電極反應為O2+2H2O+4e-=4OH-;
②得失電子相等條件下,將電極反應式相加即得電池反應式.
解答 解:(3)①根據原子經濟知,Ⅰ沒有副產物,符合原子經濟理念,Ⅱ中有副產物,不符合原子經濟理念,故選:Ⅰ;
②根據圖象知,反應物總能量大于生成物總能量,所以該反應是放熱反應,則△H1<0,故答案為:<;
③平衡時剩余一氧化碳的物質的量=0.2mol/L×2L=0.4mol,一氧化碳的轉化率=$\frac{(2-0.4)mol}{2mol}$×100%=80%,
故答案為:80%;:
(4)①該燃料電池中,正極上氧氣得電子和水生成氫氧根離子,電極反應式為O2+2H2O+4e-=4OH-,故答案為:O2+2H2O+4e-=4OH-;
②得失電子相等條件下,將電極反應式相加即得電池反應式,所以得電池反應式為2CH3OH+3O2+4KOH=2K2CO3+6H2O,故答案為:2CH3OH+3O2+4KOH=2K2CO3+6H2O
點評 本題考查“原子經濟性”概念的理解、化學平衡計算、反應中能量的變化以及燃料電池等,熟練掌握基礎是關鍵,難度中等.


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | 做銀鏡反應后的試管用氨水洗滌 | |
| B. | 做碘升華實驗后的燒杯用酒精洗滌 | |
| C. | 盛裝苯酚后的試管用鹽酸洗滌 | |
| D. | 做酯化反應后的試管用飽和Na2CO3溶液洗滌 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CDEAB | B. | ECDAB | C. | BAEDC | D. | BADCE |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
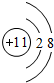 .B存在同素異形現象,其中常用作消毒劑的是O3.(填化學式)
.B存在同素異形現象,其中常用作消毒劑的是O3.(填化學式) .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③⑥⑧ | B. | ②④ | C. | ①②⑤ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯與溴反應制溴苯 | |
| B. | 苯與濃硝酸在濃硫酸作用下制硝基苯 | |
| C. | 乙醇與乙酸的酯化反應 | |
| D. | 一定條件下苯與氫氣反應制環己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 白磷(P4)是磷的單質之一,易氧化,與鹵素單質反應生成鹵化磷.鹵化磷通常有三鹵化磷或五鹵化磷,五鹵化磷分子結構(以PCl5為例)如圖所示.該結構中氯原子有兩種不同位置.
白磷(P4)是磷的單質之一,易氧化,與鹵素單質反應生成鹵化磷.鹵化磷通常有三鹵化磷或五鹵化磷,五鹵化磷分子結構(以PCl5為例)如圖所示.該結構中氯原子有兩種不同位置.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com